
【题目】某温度下,在 2L的密闭容器中,加入1molX(g)和 2molY(g)发生反应:X(g)+mY(g)3Z(g) ΔH=-Q kJ·molˉ1(Q>0),10min后该反应达到平衡时,X、Y的物质的量分别为0.9mol、1.8mol。下列叙述不正确的是
A.m=2
B.在0~10min内,X的反应速率为 0.005mol·Lˉ1·minˉ1
C.10min后,X的消耗速率等于Y的生成速率
D.在0~10min内,X和 Y反应放出的热量为 0.1Q kJ
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某离子反应涉及到ClO﹣、NH4+、N2、Cl﹣等微粒,其中N2、ClO-的物质的量随时间变化的曲线如图所示,下列说法不正确的是
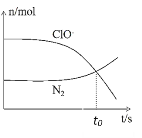
A. 该反应中ClO-为氧化剂,N2为氧化产物
B. 反应后溶液的pH减小
C. 如图t0时反应达平衡状态
D. 反应过程中每生成1 mol N2,转移6mol电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组用镀锌铁皮按下列流程制备七水合硫酸锌(ZnSO4·7H2O)

相关信息如下:①金属离子形成氢氧化物沉淀的相关pH范围。
金属离子 | pH | |
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.5 | 2.8 |
Fe2+ | 5.5 | 8.3 |
Zn2+ | 5.4 | 8.2 |
②ZnSO4的溶解度(物质在100g水中溶解的质量)随温度变化曲线。

请回答:
(1)①镀锌铁皮上的油污可用Na2CO3溶液去除,理由是____________。
②步骤Ⅰ,可用于判断镀锌层完全反应的实验现象是__________________________。
(2)步骤Ⅱ,需加入过量H2O2,理由是____(请简述理由,并且写出对应的离子反应方程式)。
(3)步骤Ⅲ,合适的pH范围是____________________。
(4)步骤Ⅳ,需要用到下列所有操作:a.蒸发至溶液出现晶膜;b.在60℃蒸发溶剂;c.冷却至室温;d.在100℃蒸发溶剂;e.过滤。请给出上述操作的正确顺序_____________(操作可重复使用)。
(5)步骤Ⅴ,某同学采用不同降温方式进行冷却结晶,测得ZnSO4·7H2O晶体颗粒大小分布如下图所示。根据该实验结果,为了得到颗粒大小相对均一的较大晶粒,宜选择_______方式进行冷却结晶。

A. 快速降温 B. 缓慢降温 C. 变速降温
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是
2NH3(g) ΔH<0,下列各项对示意图的解释与图像相符的是

A. ①压强对反应的影响(p2>p1) B. ②温度对反应的影响
C. ③平衡体系增加N2对反应的影响 D. ④催化剂对反应的影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)铅蓄电池是常用的化学电源,其电极材料是Pb和PbO2,电解液为稀硫酸。工作时该电池总反应式为:Pb+PbO2 +2H2SO4=2PbSO4+2H2O,据此判断:
①铅蓄电池的负极材料是________(写化学式);
②工作时正极反应为__________________________________________;
③工作时,电解质溶液中阴离子移向________极(填“正”或“负”)。
(2)如图A 直流电源,B为浸透饱和氯化钠溶液和酚酞试液的滤纸,C为电镀槽,接通电路后,发现B上的c点显红色,请填空:

①电源A上的a为________极(填“正”或“负”);
②滤纸B上发生的总化学方程式为___________________;
③欲在电槽中实现铁上镀锌,接通K点,使c、d两点短路,则电极f上发生的反应为________________________。电槽中放的镀液可以是___________(只需写出一种即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某盐A是由三种元素组成的化合物,且有一种为常见金属元素,某研究小组按如下流程图探究其组成:

请回答:
(1)写出组成 A的三种元素符号______。
(2)混合气体B的组成成份______。
(3)写出图中由C转化为E的离子方程式______。
(4)检验E中阳离子的实验方案______。
(5)当A中金属元素以单质形式存在时,在潮湿空气中容易发生电化学腐蚀,写出负极的电极反应式______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知 CuS、PbS、HgS 的溶度积分别为 l.3xl0﹣36、9.0x10﹣29、6.4x10﹣23.下列推断不正确的是
A. 向含 Pb2+、Cu2+、Hg2+的浓度均为 0.010 molL﹣1 的溶液中通人硫化氢气体,产生沉淀的顺序依次为 PbS、CuS、HgS
B. 在硫化铅悬浊液中滴几滴硝酸铜溶液,会生成硫化铜
C. 在含 Hg2+、Cu2+、Pb2+的溶液中滴加硫化钠溶液,当 c(S2﹣)=0.001 molL﹣1 时三种金属离子都完全沉淀
D. 硫化钠是处理废水中含上述金属离子的沉淀剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校化学小组学生利用如图所列装置进行“铁与水蒸气反应”的实验,并利用产物进一步制取FeCl3·6H2O晶体。(图中夹持及尾气处理装置均已略去)

(1)装置B中发生反应的化学方程式是__________________________。
(2)装置E中的现象是_____________________________________。
(3) 该小组学生利用B装置的固体与足量盐酸反应后的滤液制取FeCl3·6H2O晶体,设计流程如图所示:
![]()
①步骤I中通入Cl2的作用是______________________________。
② 简述检验滤液中Fe3+的操作方法________________________。
③步骤Ⅱ从FeCl3稀溶液中得到FeCl3·6H2O晶体的主要操作包括:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将标准状况下6.72LHCl溶于水配成100mL溶液,取该溶液40mL与一定量的碳酸钙恰好完全反应。计算:
(1)此盐酸的物质的量浓度。(写出计算过程,下同)_____________________
(2)参与反应的碳酸钙的质量是多少?_________________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com