
【题目】下列说法正确的是( )
A.质子数相同而中子数不同的同一种元素的不同原子互为同素异形体
B.铁是人体必需微量元素中含量最多的一种
C.在水溶液中能导电的物质一般是电解质,如HCl、H2O 、NH3、CH3COOH、NaOH、AgCl都是电解质
D.元素周期表中每一个纵列为一个族
 能力评价系列答案
能力评价系列答案 唐印文化课时测评系列答案
唐印文化课时测评系列答案 导学与测试系列答案
导学与测试系列答案科目:高中化学 来源: 题型:
【题目】在T℃时,将ag NH3完全溶于水,得到VmL溶液,假设该溶液的密度为ρg·cm-3,溶质的质量分数为w,其中含![]() 的物质的量为bmol。下列叙述中正确的是( )
的物质的量为bmol。下列叙述中正确的是( )
A.溶质的质量分数为w=![]() ×100%
×100%
B.上述溶液中再加入VmL水后,所得溶液溶质的质量分数大于0.5w
C.溶液中c(OH-)=![]() mol·L-1
mol·L-1
D.溶质的物质的量浓度c=![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用钛白粉厂废酸(主要含硫酸、Fe3+、Fe2+、TiO2+、Al3+)制备过二硫酸铵[(NH4)2S2O8],同时回收TiO(OH)2的简要流程如下: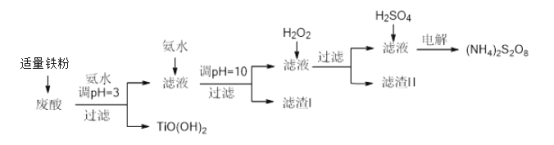
已知:i.部分离子完全生成氢氧化物沉淀的pH:
金属离子 | TiO2+ | Fe3+ | Fe2+ | Al3+ |
开始沉淀的PH | 1.2 | 1.9 | 7.0 | 3.2 |
沉淀完全的pH | 2.8 | 3.1 | 9.4 | 4.7 |
ii.pH>7时,Fe2+部分生成Fe(II)氨络离子[Fe(NH3)2]2+。
请回答下列问题:
(1)加入适量铁的作用是______________________________________。
(2)生成TiO(OH)2的化学方程式是________________________________。
(3)滤渣I、滤渣Ⅱ中均含有的物质的化学式是___________________________。
(4)加入H2O2的目的是氧化除掉Fe(II)氨络离子[Fe(NH3)2]2+,配平下列离子方程式:
2[Fe(NH3)2]2+ +____________+4H2O +H2O2 =___________ + 4NH3·H2O 。
(5)常温下,电解液中含硫微粒主要存在形式与pH的关系如下图所示。
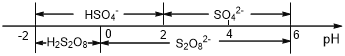
在阳极放电的离子主要为HSO4-,阳极区电解质溶液的pH范围为___________________________________
(6)已知Ksp[Al(OH)3]=3.2×10-34 ,当pH=10 时,求溶液中c(Al3+)=______________
(7)25℃,pH=3的(NH4)2SO4溶液中,计算2c(SO42-)- c(NH4+) =_______mol/L(列式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,将0.1molL﹣1 NaOH溶液加入20mL0.1molL﹣1CH3COOH溶液中,所加入溶液的体积(V)和混合液的pH关系曲线如图所示。下列结论正确的是( )
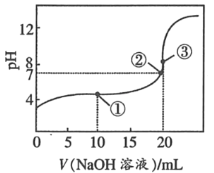
A.①点时,c(CH3COO﹣)+c(CH3COOH)=c(Na+)
B.对曲线上①②③任何一点,溶液中都有c(Na+)+c(H+)=c(OH﹣)+c(CH3COO﹣)
C.③点时,醋酸恰好完全反应完溶液中有c(CH3COO﹣)=c(Na+)>c(H+)=c(OH﹣)
D.滴定过程中可能出现c(H+)>c(Na+)>c(CH3COO﹣)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na2S2O35H2O俗称“海波”,是重要的化工原料,常用作脱氯剂、定影剂和还原剂。
(1)Na2S2O3还原性较强,在碱性溶液中易被Cl2氧化成SO42﹣,常用作脱氯剂,该反应的离子方程式是_____。
(2)测定海波在产品中的质量分数:依据反应2S2O32﹣+I2=S4O62﹣+2I﹣,可用I2的标准溶液测定产品的纯度。称取5.500g产品,配制成100mL溶液。取10.00mL该溶液,以淀粉溶液为指示剂,用浓度为0.05000molL﹣1I2的标准溶液进行滴定,相关数据记录如表所示。
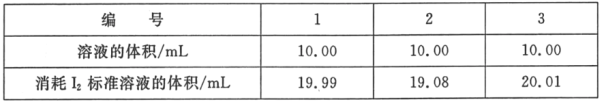
①判断滴定终点的现象是_____。
②若滴定时振荡不充分,刚看到溶液局部变色就停止滴定,则测量的Na2S2O35H2O的质量分数会_____(填“偏高”、“偏低”或“不变”)
③计算海波在产品中的质量分数(写出计算过程)。_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁能形成多种化合物,如Fe(SCN)3,[Fe(CO)5](羰基铁),它们在生活生产中有广泛应用。
(1)Fe3+基态核外电子排布式为_____。
(2)实验室用KSCN溶液、苯酚溶液检验Fe3+.N、O、S的第一电离能由大到小的顺序为____ 。SCN﹣中的碳原子的杂化轨道类型为_____。与SCN﹣互为等电子体的分子是_____。
(3)羰基铁[Fe(CO)5]可用作催化剂。1mol[Fe(CO)5]分子中含σ键数目为_____。
(4)某种氮化铁晶胞的晶体如图所示,该氮化铁晶体的化学式为_____。
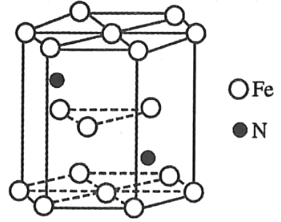
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KCl样品中含有少量KOH、K2SO4和不溶于水的杂质,为了提纯KCl,某同学先将样品溶于适量水中,充分搅拌后过滤,再将滤液按下图所示步骤进行操作
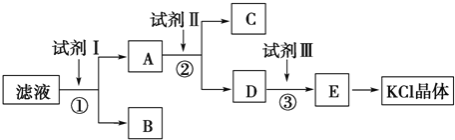
(1)试剂Ⅰ的化学式为__________,其作用是除去__________(填离子符号),
检验该离子完全除尽的操作是__________________________________________
(2)加入试剂Ⅱ时发生反应的化学方程式为_____________________________
(3)试剂Ⅲ的名称是__________,各步操作中所加试剂都必须过量,欲检验试剂Ⅲ已经过量,可以选用__________(填字母).
A.AgNO3 B.pH试纸 C.K2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)相同物质的量的钠、镁、铝与足量盐酸反应时放出氢气的体积比为__________。分别为0.3 mol的钠、镁、铝投入100 mL 1 mol·L-1的硫酸溶液中,三者产生的体积比是_______。
(2)在一个用铝制的易拉罐内充满CO2气体,然后往罐内注入足量的NaOH溶液,立即用胶布密封罐口。经过一段时间后,罐壁内凹而瘪,再过一段时间后,瘪了的罐壁重新鼓起来。罐壁内凹而瘪的原因是_____________,离子方程式可能为____________________;罐再鼓起的原因是________________,离子方程式可能为________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合硫酸铁可用于水的净化,其化学式可表示为[Fea(OH)b(SO4)c]m。取一定量聚合硫酸铁样品与足量盐酸反应,将所得溶液平均分为两份。向一份溶液中加入足量的BaCl2溶液,得到白色沉淀1.7475 g。取另一份溶液,先将Fe3+还原为Fe2+(还原剂不是Fe,且加入的还原剂恰好将Fe3+还原为Fe2+),再用0.020 00 mol/LK2Cr2O7标准溶液滴定至终点,消耗K2Cr2O7标准溶液50.00 mL。该聚合硫酸铁样品中a∶b为 ( )
A.1∶1B.2∶1C.3∶1D.2∶5
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com