
| A. | 1000mL 50.0g | B. | 950mL 47.5g | C. | 950mL 30.4g | D. | 1000mL 32.0g |
科目:高中化学 来源: 题型:解答题
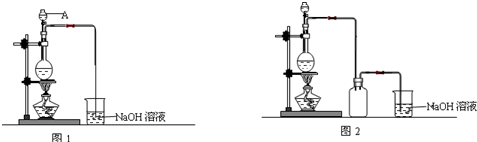
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 使用容量瓶前必须检查容量瓶是否漏水 | |
| B. | 容量瓶用蒸馏水洗净后,再用待配溶液润洗 | |
| C. | 称好的固体试样需用纸条小心地送入容量瓶中 | |
| D. | 摇匀后发现凹液面下降,再加水至刻度线 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
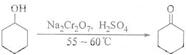
| 物质 | 沸点(℃) | 密度(g-cm-3,20℃) | 溶解性 |
| 环己醇 | 161.1(97.8)* | 0.9624 | 能溶于水 |
| 环己酮 | 155.6(95)* | 0.9478 | 微溶于水 |
| 水 | 100.0 | 0.9982 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
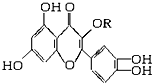 天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )
天然维生素P(结构如图,分子结构中R为饱和烃基)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述正确的是( )| A. | 1mol该物质可与5molNaOH发生反应 | |
| B. | 1mol该物质与足量溴水反应,最多消耗6molBr2 | |
| C. | 一定条件下1mol该物质可与H2加成,消耗H2最大量为6mol | |
| D. | 维生素P能发生水解反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
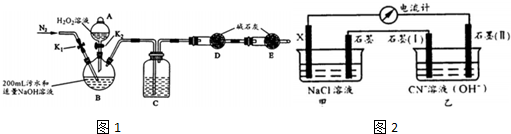
| 步骤1 | 关闭K1,打开K2,滴入足量H2O2溶液,对B加热.充分反应后,停止加热 |
| 步骤2 | 关闭K2,用注射器穿过B装置的胶塞注入 稀H2S04溶液 |
| 步骤3 | 打开K1,通入N2 |
| 实验序号 | 电极(X) | NaCl溶液浓度 (mol/L) | 甲中石墨表面通入气体 | 电流计读数 (A) |
| (1) | Fe | 0.1 | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5I |
| (3) | Fe | 0.1 | O2 | 2I |
| (4) | Al | 0.5 | 空气 | 1.6I |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | ①④⑥ | B. | ①②④⑤⑥ | C. | ①④⑤⑥ | D. | 全部 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
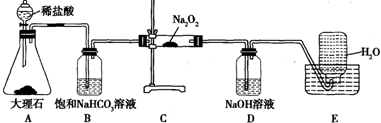
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com