
(1)请回答下列问题:
①已知:①CO(g) + 1/2O2(g) = CO2(g) △H= -283.0kJ·mol-1
② CH3OH(l) + 3/2O2(g) = CO2(g)+2H2O(l) △H= -726.5kJ·mol-1
请写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:____________________________________________________________________;
②已知拆开1molH-H键、1molCl-Cl键、1molH—Cl键分别需要的能量是436kJ、243kJ、432kJ,则反应则反应:H2(g)+ Cl2(g) = 2HCl (g) 的△H= 。
(2)已知25℃、101 kPa下,稀的强酸与稀的强碱溶液反应的中和热为 -57.3 kJ/mol。
①则表示稀硫酸与稀烧碱溶液中和反应的热化学方程式为: 。
②测定中和热实验时所需的玻璃仪器有烧杯、量筒、 、 。
(1)①(3分) CH3OH(l) + O2(g) === CO(g)+2H2O(l) △H=-443.5kJ·mol-1 (不标状态、化学式错0分;化学式和状态正确1分,条件和系数1分,反应热1分)
②(2分)-185kJ/mol(数值1分,单位1分)
(2)①(3分)1/2H2SO4(aq)+NaOH(aq)=1/2Na2SO4(aq)+H2O(l) ΔH =﹣57.3 kJ/mol (不标状态、化学式错0分;化学式和状态正确1分,条件和系数1分,反应热1分)
②(2分)温度计 环形玻璃搅拌棒(顺序颠倒也可)
【解析】
试题分析:(1)②用键能来表示反应热的话,是用反应物的键能总和减去生成物的键能总和。(2)①中和热的热化学方程式是表示生成1 mol水的时候所放出的热量,要注意与热化学方程式的区别。
考点:考查反应热的有关知识。


 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案 单元全能练考卷系列答案
单元全能练考卷系列答案 新黄冈兵法密卷系列答案
新黄冈兵法密卷系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
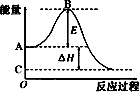
 2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.
2SO2(g)+O2(g)?2SO3(g)反应过程的能量变化如图所示.查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 312 |
| a3NA |
| 312 |
| a3NA |

查看答案和解析>>
科目:高中化学 来源: 题型:
 (1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:
(1)在25℃、101kPa下,1g甲烷完全燃烧生成CO2和液态H2O,放出55kJ的热量,写出表示甲烷燃烧热的热化学方程式:查看答案和解析>>
科目:高中化学 来源: 题型:
 Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.
Q、W、X、Y、Z是5种短周期元素,原子序数逐渐增大;W与Q按1:4形成的化合物A是一种重要能源;W与Y,X与Y组成的化合物是常见的大气污染物;Y与Z按1:1形成的离子化合物B,其摩尔质量为78g?mol-1.请回答下列问题.查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com