
【题目】重铬酸钾是一种常见的强氧化剂。实验室以精选铬铁矿(主要成分可表示FeO·Cr2O3,还含有 SiO2、 Al2O3 等杂质)为原料制备重铬酸钾晶体(K2Cr2O7,式量294)的流程如下:

请回答下列问题:
操作1中发生的反应有:
4FeO·Cr2O3+8Na2CO3+7O2![]() 8Na2CrO4+2Fe2O3+8CO2↑;
8Na2CrO4+2Fe2O3+8CO2↑;
Na2CO3+Al2O3![]() 2NaAlO2+CO2↑;Na2CO3+SiO2
2NaAlO2+CO2↑;Na2CO3+SiO2![]() Na2SiO3+CO2↑
Na2SiO3+CO2↑
该步骤在常温下的反应速度较慢,为使反应速率增大,可采取的两条措施是____________。
(2)固体Y 中主要含有______________。(填写化学式)
(3)酸化步骤使含铬物质发生了转化,请写出离子反应方程式______________________。
(4)操作 4 中的化学反应在溶液中能发生的可能理由是_________________________;获得 K2Cr2O7 晶体的操作依次是:加入KCl 固体,在水浴上加热浓缩至______________,冷却结晶,抽滤,洗涤,干燥。
(5)通过下列实验可测定产品中重铬酸钾的质量分数:称取重铬酸钾试样 1.470g,用100mL 容量瓶配制成溶液。移取25.00mL 溶液于碘量瓶中,加入适里稀硫酸和足量碘化钾(铬的还原产物为 Cr3+),放于暗处 5min。然后加入一定量的水,加入淀粉指示剂,用0.1500mol/L 标准溶液滴定,共消耗标准液36.00mL。滴定时发生的反应的离子方程式为:I2+2S2O32-=2I-+S4O62-;则所测产品中重铬酸钾的纯度为_____________。
(6)有关上述实验过程中涉及的部分实验操作的描述,正确的是_________.
A.粗产品若要进一步提纯,可以采用重结晶的方法
B. 配制溶液时,用托盘天平称取试样后,一般经溶解、转移(含洗涤)、定容等步骤,配制成100mL溶液
C.滴定时,当最后一滴标准溶液滴入时,溶液变为蓝色,且半分钟内不变色,可判断滴定终点
D.滴定终点时俯视读数,测定结果偏低
【答案】
(1)升高温度、将原料粉碎(或使用催化剂);
(2)Al(OH)3、 H2SiO3;
(3)2CrO42-+2H+![]() Cr2O72-+H2O;
Cr2O72-+H2O;
(4)该条件下,K2Cr2O7 的溶解度较小;溶液表面出现晶膜(或溶液中析出固体)
(5)72.00%;
(6)AD。
【解析】
试题分析:(1)操作1中为使反应速率增大,可采取的两条措施是升高温度、将原料粉碎(或使用催化剂),故答案为:升高温度、将原料粉碎(或使用催化剂);
(2)根据上面的分析可知,固体Y的成份为Al(OH)3、H2SiO3,故答案为:Al(OH)3、H2SiO3;
(3)结合流程图可知,酸化为了转化CrO42-离子为Cr2O72-,反应的离子方程式为2CrO42-+2H+=Cr2O72-+H2O,故答案为:2CrO42-+2H+=Cr2O72-+H2O;
(4)操作4是向含Cr2O72-的溶液中加入氯化钾,生成溶解度极小的K2Cr2O7,所以该反应在溶液中能发生的可能理由是在该条件下,K2Cr2O7的溶解度较小,从K2Cr2O7溶液中获得晶体,要将溶液蒸发浓缩到有少量晶体析出再冷却结晶,故答案为:该条件下,K2Cr2O7的溶解度较小;溶液表面出现晶膜(或溶液中析出固体);
(5)根据实验步骤可知,用碘化钾Cr2O72-将还原成Cr3+,根据电子得失守恒有关系式Cr2O72-~3I2,再用Na2S2O3标准溶液滴定( I2+2S2O32-═2I-+S4O62-),所以有关系式Cr2O72-~3I2~6S2O32-,Na2S2O3的物质的量为0.1500mol/L×36.00mL=5.4×10-3 mol,所以样品中K2Cr2O7的物质的量![]() ×5.4×10-3 mol×
×5.4×10-3 mol×![]() =3.6×10-3 mol,样品中K2Cr2O7的纯度为
=3.6×10-3 mol,样品中K2Cr2O7的纯度为![]() ×100%=72%,故答案为:72%;
×100%=72%,故答案为:72%;
(6)A.粗产品中可能含有氯化钠杂质,所以若要进一步提纯,可以用重结晶的方法,故A正确;B.配制溶液时,用托盘夭平称取试样后,一般经溶解、转移(含洗涤)、定容、摇匀等步骤,配制成100mL溶液,故B错误;C.滴定时,用Na2S2O3滴定I2,滴定终点时溶液由蓝色变为无色,故C错误;D.滴定终点时俯视读数,测定结果偏低,读取的标准液体积偏小,所以测得的结果偏低,故D正确,故选AD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】A、B、C均为中学化学常见的纯净物,它们之间存在如下转化关系,其中①②③均为有单质参与的反应。
![]()
(1)若A是常见的金属,①③中均有同一种气态非金属单质参与反应,B溶液遇KSCN显血红色,且②为化合反应,写出反应②的离子方程式________。
(2)若B是太阳能电池用的光伏材料,①②③为工业制备B的反应。C的化学式是______,写出反应①的化学方程式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中错误的是
A. 过滤操作时,如果有必要可以用蒸馏水洗涤滤纸上的沉淀2-3次
B. 蒸馏操作时,应使温度计水银球插入液态混合物中
C. 分液操作时,分液漏斗中下层液体从下口放出,上层液休从上口倒出
D. 萃取操作时,萃取剂要和原溶液互不相容,且不能与溶质和溶剂反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于密闭容器中可逆反应 A2(g)+3B2(g)![]() 2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )
2AB3(g),探究单一条件改变情况下,可能引起平衡状态的改变,得到如下图所示的曲线(图中T表示温度,n 表示物质的量)下列判断正确的是( )

A.加入催化剂可以使状态 d 变为状态 b
B.若 T1>T2,则逆反应一定是放热反应
C.达到平衡时 A2 的转化率大小为: b>a>c
D.在T2 和n(A2)不变时达到平衡,AB3 的物质的量大小为: c>b>a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法或操作中,正确的有( )
①标准状况下,1 mol溴单质的体积约为22.4 L ②用托盘天平称量50.56 g KCl固体 ③用酒精从饱和碘水中萃取碘
④让一束光通过胶体,从垂直于光线的方向可以看到一条光亮的“通路” ⑤从含有少量氯化钠的硝酸钾溶液中提取硝酸钾可用结晶的方法
A. 1个 B. 2个
C. 3个 D. 4个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法正确的是
A. 2,2-二甲基丁烷与2,4-二甲基戊烷的一氯代物种类数相同
B. 乙烷、苯、裂化汽油溶液均不能使酸性高锰酸钾溶液褪色
C. 苯的密度比水小,但由苯反应制得的溴苯、硝基苯、环已烷的密度都比水大
D. 乙酸乙酯在碱性条件下的水解反应称为皂化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图象不正确的是
A. 向100ml0.1mol·L-1H2SO3溶液中滴加0.1mol·L-1Ba(OH)2溶液至过量
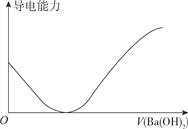
B. 向100ml0.1mol·L-1H2SO4溶液中加入NaOH固体
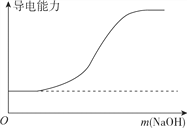
C. 向一定浓度的氯化钠溶液中加水
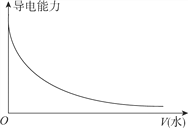
D. 向蒸馏水中通入HCl气体
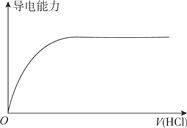
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L恒容密闭容器中充入2 mol X和1mol Y发生反应:2X(g) +Y(g)![]() 3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
3Z(g) △H<0,反应过程持续升高温度,测得混合体系中X的体积分数与温度的关系如图所示。下列推断正确的是
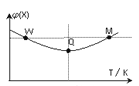
A. 升高温度,平衡常数增大
B. W点X的正反应速率小于M点X的正反应速率
C. Q点时,Y的转化率最小
D. 平衡时充入Z,达到新平衡时Z的体积分数比原平衡时大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com