
【题目】钛镍形状记忆合金(TiNi)被广泛用于人造卫星和宇宙飞船的天线,在临床医疗领域内也具有广泛的应用。回答下列问题:
(1)写出基态Ti原子的电子排布式:_________,Ni在元素周期表中的位置是_________。
(2)钛镍合金能溶于热的硫酸生成Ti(SO4)2、NiSO4,二者阴离子的立体构型为______,中心原子的轨道杂化类型是_______。
(3)与钛同周期的另一种元素钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,现象是____________;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,则第二种配合物的化学式为 _______________ 。
(4)一种钛镍合金的立方晶胞结构如图所示:

①该合金中Ti的配位数为________。
②若合金的密度为d g/cm3,晶胞边长a=________pm。(用含d的计算式表示)
【答案】 1s22S22p63s23p63d24s2或[Ar] 3d24s2 第4周期第VIII族 正四面体 sp3 产生白色沉淀 [Co (NH3)5SO4]Br 6 ![]() ×1010 或
×1010 或![]() ×103
×103
【解析】(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
原子的电子排布式为1s22S22p63s23p63d24s2,或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族。
(2) 阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为4,属于sp3 杂化,为正四面体构型。
(3)往其溶液中加BaCl2溶液,有白色沉淀,所以该物质为[Co(NH3)5Br]SO4;另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co(NH3)5SO4]Br。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6。
②此晶体属于面心立方晶型,每个晶胞中含有4个Ti原子,根据ρ=m/V进行计算。
(1) Ti原子序数为22,其基态![]() 原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
原子的电子排布式为1s22S22p63s23p63d24s2或[Ar] 3d24s2 ;Ni元素的原子序数为28,在元素周期表位于第4周期第Ⅷ族;正确答案:1s22s22p63s23d24s2或[Ar] 3d24s2 ;第4周期第VIII族。
(2) Ti(SO4)2、NiSO4中,阴离子是SO2-4;根据价层电子对互斥理论可知价层电子对数为(6+2)/2=4,则中心原子S原子为sp3 杂化,其空间立体构型是正四面体;正确答案:正四面体;sp3。
(3) 一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液,发生反应Ba2++SO42-=BaSO4↓,产生白色沉淀;往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co (NH3)5SO4]Br ;正确答案:产生白色沉淀;[Co (NH3)5SO4]Br 。
(4)①根据晶胞可以看出,每个Ti原子周围距离最近的Ni原子有6个,所以Ti的配位数为6;正确答案:6。
②由晶胞可知,此晶体属于面心立方晶型,而且Ti占据晶胞的顶点和面心,Ni占据晶胞的棱心和体心,则每个晶胞中含有1/4×12+1=4个Ni原子和1/2×6+1/8×8=4个Ti原子,设晶胞晶胞边长apm,则有一个晶胞的质量为(a×10-10)3×d=4×107/NAg,解得a3=![]() ×1030,a=
×1030,a=![]() ×1010 pm 或
×1010 pm 或![]() ×103 pm;正确答案:
×103 pm;正确答案:![]() ×1010 或
×1010 或![]() ×103。
×103。


 习题精选系列答案
习题精选系列答案科目:高中化学 来源: 题型:
【题目】短周期主族元素A、B、C、D、E的原子序数依次增大,其中A、D同主族,B、C、D、E同周期,A原子的最外层电子数是次外层电子数的3倍,B是短周期元素中原子半径最大的主族元素,C原子的质子数比B原子的质子数多2个。请回答下列问题:
(1)B元素的名称为___________,D的元素符号为___________,E的离子结构示意图为___________。
(2)D、E两种元素可形成化学式为DE2、D2E2等化合物,则DE2的电子式为___________________,D2E2的结构式为___________(请填写具体物质的化学式)。
(3)将B2A2投入到B2D的水溶液中可生成D的单质,发生反应的离子方程式为:______________________,请用单线桥标出此反应中电子转移的方向和数目。
(4)DA2与E元素的单质在水中反应的离子方程式为:_________________________________。
(5)向由C、E两种元素组成的化合物溶液400mL1 mol/L中加入500mL—定物质的量浓度的KOH溶液,得到白色沉淀15.6 g,则KOH溶液的物质的量浓度为___________mol/L或___________mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图片是立方烷(cunane)的球棍模型,下列有关说法不正确的是( )

A. 其一氯代物只有一种
B. 其二氯代物有三种同分异构体
C. 常温下为气体
D. 它与苯乙烯(C6H5—CH===CH2)互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在下列各图曲线中分别表示物质的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质),下列选项中的对应关系错误的是

A. 图①可以表示F-、Na+、Mg2+、Al3+四种离子的离子半径大小关系
B. 图②可以表示ⅡA族元素的最外层电子数
C. 图③可以表示ⅥA族元素氢化物的沸点高低关系
D. 图④可以表示第三周期中的非金属元素对应单质的熔点高低关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按1︰1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
2Z ,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3︰2,则Y的转化率最接近于( )
A. 33%B. 40%C. 50%D. 66%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校学生用如图所示装置进行实验,以探究苯与溴发生反应的原理并分离提纯反应的产物。请回答下列问题:

(1)实验开始时,关闭K2、开启K1和分液漏斗活寒,滴加苯和液溴的混合液,反应开始。装置II中生成有机物的反应为__________(填化学方程式),装置III中小试管内苯的作用是__________。
(2)能说明苯与液溴发生了取代反应的现象是__________。
(3)反应结束后,要让装置I中的水倒吸入装置II中。这样操作的目的是__________,简述这一操作的方法:______________________________。
(4)将三颈烧瓶内反应后的液体依次进行下列实验操作就可得到较纯净的溴苯。
①用蒸馏水洗涤,振荡,分液;
②用5%的溶液洗涤,振荡,分液;
③用蒸馏水洗涤,振荡,分液;
④加入无水CaCl2粉末干燥;
⑤__________(填操作名称).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图装置中,U形管内为红墨水,a、b试管内分别盛有食盐水和氯化铵溶液(呈酸性),各加入生铁块,放置一段时间。下列有关描述错误的是( )

A. 生铁块中的碳是原电池的正极
B. 红墨水柱两边的液面变为左低右高
C. 两试管中相同的电极反应式是:Fe →Fe2++2e-
D. a试管中发生了吸氧腐蚀,b试管中发生了析氢腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:有下列物质:①O2 ②CO2 ③NH3 ④Na2O ⑤Na2O2 ⑥NaOH ⑦CaBr2 ⑧H2O2 ⑨NH4Cl ⑩N2,回答下列问题:
(1)只含有极性键的是________;只含有非极性键的是________;含有极性键和非极性键的是________;只含有离子键的离子化合物是________;含有非极性键的离子化合物是________;
(2)写出⑤、⑧、⑨的电子式_____________、______________、________________;
(3)溶于水只破坏离子键的是__________;溶于水既破坏离子键又破坏共价键的是________________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】隔绝空气加热至500℃时硫酸亚铁铵[(NH4)2Fe(SO4)2]能完全分解,分解产物中含有铁 氧化物、硫氧化物、氨气和水蒸气等。
[实验探究]某化学小组选用下图所示部分装置进行分步实验(夹持装置略)。
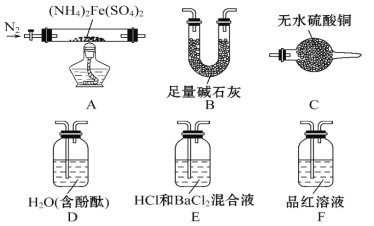
实验Ⅰ 甲同学为探究分解产物中的硫氧化物是 SO2 还是 SO3,连接装置A-E-F-B 进行实验。
(1)实验过程中观察到:E 中没有明显现象,F 中溶液褪色,据此得出的结论是 。
(2)B 的作用是_____。
实验Ⅱ 验证分解产物中含有水蒸气和氨气,并探究残留固体成分。
(3)所选用装置的正确连接顺序为_____(填装置的字母序号)。
(4)证明有水蒸气生成的实验现象为_____。
(5)证明有氨气生成的实验现象为_____。
(6)A 中固体完全分解后变为红棕色粉末,设计实验证明A 中残留固体中含有三价铁_______________。
(7)实验证明(NH4)2Fe(SO4)2 受热分解除上述产物外,还有N2 生成,写出A 中反应的化学方程式__________ 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com