
能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.向FeBr2溶液中通入过量氯气 2Fe2++Cl2===2Fe3++2Cl-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
N2(g)+3H2(g)≒2NH3(g) △H=-92.2KJ/mol。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是

A.若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变
B.第25min改变的条件是将NH3从反应体系中分离出去
C.若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度
D.前25min内反应放出的热量为46.lkJ
查看答案和解析>>
科目:高中化学 来源:2014-2015学年甘肃省天水市高三第五次检测考试理综化学试卷(解析版) 题型:填空题
【化学——选修3:物质结构与性质】(15分)
卤族元素的单质和化合物很多,我们可以利用所学物质结构与性质的相关知识去认识和理解它们。
(1)卤族元素位于元素周期表的_________区;溴的价电子排布式为____________________。
(2)在一定浓度的溶液中,氢氟酸是以二分子缔合(HF)2形式存在的。使氢氟酸分子缔合的作用力是________。
(3)请根据下表提供的第一电离能数据判断,最有可能生成较稳定的单核阳离子的卤素原子是_________。
氟 | 氯 | 溴 | 碘 | |
第一电离能 (kJ/mol) | 1681 | 1251 | 1140 | 1008 |
(4)已知碘酸(HIO3)和高碘酸(H5IO6)的结构分别如图1、2所示:

请比较二者酸性强弱:HIO3_____ H5IO6(填“>”、 “<”或“=”)。
(5)已知ClO2-为角型,中心氯原子周围有四对价层电子。ClO2-中心氯原子的杂化轨道类型为___________,写出一个ClO2-的等电子体__________。
(6)图3为碘晶体晶胞结构。有关说法中正确的是____________。
A.碘分子的排列有2种不同的取向,2种取向不同的碘分子以4配位数交替配位形成层结构
B.用均摊法可知平均每个晶胞中有4个碘原子
C.碘晶体为无限延伸的空间结构,是原子晶体
D.碘晶体中存在的相互作用有非极性键和范德华力
(7)已知CaF2晶体(图4)的密度为ρg/cm3,NA为阿伏加德罗常数,棱上相邻的两个Ca2+的核间距为a cm,则CaF2的相对分子质量可以表示为___________。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:填空题
(10分)某铝合金中含有铁、铝、镁、铜、硅。为了测定该合金中铝的含量,现设计了如下实验:
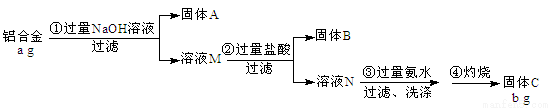
已知:Si+ 2NaOH + H2O = Na2SiO3 + 2H2↑,H2SiO3是不溶于水的弱酸。
(1)固体A的成分是:____________,溶液M中的阴离子有:____________________
(2)步骤③中生成沉淀的离子方程式为:_____________________________________
(3)该样品中铝的质量分数是:_______________________________(用a、b表示)。
(4)下列因操作不当,会使测定结果偏大的是___________
A.第①步中加入NaOH溶液不足 B.第②步中加入盐酸不足时
C.第④步中的沉淀未用蒸馏水洗涤 D.第④步对沉淀灼烧不充分
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
下列事实说明HNO2为弱电解质的是
①0.1 mol/L HNO2溶液的pH=2.1; ②常温下NaNO2溶液的pH>7 ;
③用HNO2溶液做导电实验时,灯泡很暗; ④HNO2溶液和KCl溶液不发生反应
⑤HNO2能与碳酸钠反应制CO2; ⑥HNO2不稳定,易分解
A.①②③⑤ B.①②④⑤ C.①②⑥ D.①②
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:填空题
(12分)皮革工业污泥中含较多的Cr,工业采用以下工艺制得M[Cr(OH)(H2O)5SO4]。

已知:①工艺中硫酸浸取液中的金属离子主要是Cr3+,其次是Fe3+、Al3+、Cu2+、Mg2+。
②常温下部分阳离子以氢氧化物沉淀形式存在时溶液的pH见下表:
阳离子 | Fe3+ | Al3+ | Cu2+ | Mg2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 3.7 | 4.7 | 9.3 | --- |
沉淀完全时的pH | 3.2 | 8.0 | 6.7 | 11.1 | 9(>9溶解) |
(1)酸浸时,为了提高浸取效率可采取的措施是________________(任写一条)。
(2)调节pH所用X可以选用 。
A.NaOH B.Na2CO3 C.H2SO4 D.HNO3
(3)加入H2O2 目的是把Cr(OH)3沉淀转化为Cr2O72-,写出该反应的离子方程式 。针铁矿组成元素是Fe、H、O,化学式量为89,其化学式是______________。
(4)调滤液至pH=8,Al3+、Cu2+、Mg2+中的_________将转化为沉淀。
(5)若滤液甲的pH=a,则溶液中c (Cu2+)= 。(25℃时的Ksp[ Cu(OH)2]=2.2×10-20)
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省龙岩市一级达标校高三上学期期末化学试卷(解析版) 题型:选择题
向恒温恒容密闭容器中加入1molHI,发生下列反应2HI(g) H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
H2(g)+I2(g),△H >0。达到平衡后,往容器中再加入1molHI,有关说法正确的是
A.平衡不移动,HI平衡转化率不变
B.平衡向右移动,HI平衡转化率不变
C.平衡向左移动,HI平衡转化率减小
D.平衡向右移动,HI平衡转化率增大
查看答案和解析>>
科目:高中化学 来源:2014-2015学年安徽省淮北市高三第一次模拟考试化学试卷(解析版) 题型:选择题
室温下,下列溶液中粒子关系关系正确的是
A.Na2CO3溶液:c(Na+)+c(H+)=c(H2CO3)+c(HCO3-)+c(OH-)+c(CO32-)
B.NaHSO3溶液:c(H+)+c(H2SO3)=c(HSO3-)+c(OH-)
C.KAl(SO4)2溶液:c(SO42-)>c(K+)>c(Al3+)>c(H+)>c(OH-)
D.NH4Cl和CaCl2混合溶液:c(Cl-)>c(Ca2+)>c(NH4+)>c(H+)>c(OH-)
查看答案和解析>>
科目:高中化学 来源:2014-2015陕西岐山县高二上学期期末考试化学(文)试卷(解析版) 题型:选择题
为了鉴别某白色纺织品的成分是蚕丝还是人造丝(合成纤维),可选用的方法
A.滴加酒精 B.取少量样品灼烧
C.滴加食盐水溶液 D.滴加食醋
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com