
N2(g)+3H2(g)≒2NH3(g) △H=-92.2KJ/mol。在2L恒容密闭容器中各物质的浓度随时间变化的曲线如图所示。下列说法错误的是

A.若时段I中投入物质的浓度为原来的2倍,则反应物的转化率增大,平衡常数不变
B.第25min改变的条件是将NH3从反应体系中分离出去
C.若第60min时反应又达到了平衡,则时段Ⅲ改变的条件是降低温度
D.前25min内反应放出的热量为46.lkJ
D
【解析】
试题分析:在2L恒容密闭容器中N2(g)+3H2(g) 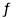 2NH3(g) △H=-92.2KJ/mol。A项若时段I中投入物质的浓度为原来的2倍,则相当于等效的两个相同体系合,合并瞬间反应物的转化率不变,但单位体积内体系微粒数目增多,平衡正向移动使单位体积内体系微粒数目减少,故反应物转化率增大,且温度不变,平衡常数不变,A项正确;由图象可知25min时,N2、H2的浓度均不变,但NH3的浓度瞬间降低,故改变条件是将NH3从反应体系中分离出去,B项正确;时段3,第45min时各微粒浓度均不变,但平衡正向移动故改变条件为降低温度,C项正确;第25min时N2浓度有1.0mol/L降低为0.50mol/L,改变量为1mol,故放出热量为92.2 KJ/mol,D项错误;本题选D。
2NH3(g) △H=-92.2KJ/mol。A项若时段I中投入物质的浓度为原来的2倍,则相当于等效的两个相同体系合,合并瞬间反应物的转化率不变,但单位体积内体系微粒数目增多,平衡正向移动使单位体积内体系微粒数目减少,故反应物转化率增大,且温度不变,平衡常数不变,A项正确;由图象可知25min时,N2、H2的浓度均不变,但NH3的浓度瞬间降低,故改变条件是将NH3从反应体系中分离出去,B项正确;时段3,第45min时各微粒浓度均不变,但平衡正向移动故改变条件为降低温度,C项正确;第25min时N2浓度有1.0mol/L降低为0.50mol/L,改变量为1mol,故放出热量为92.2 KJ/mol,D项错误;本题选D。
考点:化学平衡图像问题。


 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案科目:高中化学 来源:2014-2015学年浙江省高三第一次五校联考化学试卷(解析版) 题型:填空题
(13分)研究和深度开发CO、CO2的应用对构建生态文明社会具有重要的意义。
(1)CO可用于炼铁,已知:Fe2O3(s) + 3C(s)=2Fe(s) + 3CO(g) ΔH 1=+489.0 kJ·mol-1,
C(s)+CO2(g)=2CO(g) ΔH 2 =+172.5 kJ·mol-1
则CO还原Fe2O3(s)的热化学方程式为 。
(2)分离高炉煤气得到的CO与空气可设计成燃料电池(以KOH溶液为电解液)。写出该电池的负极反应式: 。
(3)CO2和H2充入一定体积的密闭容器中,在两种温度
下发生反应:CO2(g)+3H2(g) CH3OH(g)+H2O(g)
CH3OH(g)+H2O(g)
测得CH3OH的物质的量随时间的变化见图。
① 曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。
曲线I、Ⅱ对应的平衡常数大小关系为KⅠ KⅡ(填“>”或“=”或“<”)。

②一定温度下,在容积相同且固定的两个密闭容器中,按如下方式加入反应物,一段时间后达到平衡。
容 器 | 甲 | 乙 |
反应物投入量 | 1molCO2、3molH2 | a molCO2、b molH2、 c molCH3OH(g)、c molH2O(g) |
若甲中平衡后气体的压强为开始的0.8倍,要使平衡后乙与甲中相同组分的体积分数相等,且起始时维持化学反应向逆反应方向进行,则c的取值范围为 。
③一定温度下,此反应在恒压容器中进行,能判断该反应达到化学平衡状态的依据是 。
a.容器中压强不变
b.H2的体积分数不变
c.c(H2)=3c(CH3OH)
d.容器中密度不变
e.2个C=O断裂的同时有6个H-H断裂
(4)将燃煤废气中的CO2转化为二甲醚的反应原理为:2CO2(g) + 6H2(g) CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。
CH3OCH3(g) + 3H2O(g)。已知一定条件下,该反应中CO2的平衡转化率随温度、投料比[n(H2) / n(CO2)]的变化曲线如下左图。在其他条件不变时,请在右图中画出平衡时CH3OCH3的体积分数随投料比[n(H2) / n(CO2)]变化的曲线图。

查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省潍坊市高三12月月考化学试卷(解析版) 题型:选择题
下列推断正确的是
A.绿色化学的核心是应用化学原理对环境污染进行治理
B.硅是地壳中含量位居第二的元素,玛瑙、光导纤维的主要成分为SiO2
C.配制240 mL 1 mol·L-1的NaOH溶液需称NaOH固体的质量为9.6 g
D.要除去衣服上的顽固污渍,均可将衣服泡在漂白液中
查看答案和解析>>
科目:高中化学 来源:2014-2015学年山东省高三上学期期末考试化学试卷(解析版) 题型:选择题
下列与有机物相关的说法正确的是
A.正丁烷和异丁烷互为同分异构体,分子中含有相同数目的C-C单键
B.酒精能使蛋白质变性,医疗上常用无水酒精作消毒剂
C.地沟油可用作汽车燃料,其组成与汽油、煤油、柴油相同
D.淀粉和纤维素都属于糖类,但纤维素不能水解
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
过碳酸钠(2Na2CO3·3H2O2)俗称固体双氧水,是一种很好的消毒剂和供氧剂。湿法生产过碳酸钠的原理和线路如图所示(BC—1,BC—2均为稳定剂):

请回答下列问题:
(1)H2O2中添加BC—Ⅰ的目的是 ;工业纯碱中常含有微量Fe3+,加入BC—2可与Fe3+形成配合物,这样做的原因是 。
(2)过碳酸钠在高温下容易分解,所以制取时反应需控制在5℃以下进行。在反应釜中发生的主要反应为 ;常温结晶的过程中加入氯化钠、搅拌,作用是 。
(3)下列关于过碳酸钠使用和保存的说法不正确的是 。(填字母标号)
A.应与易燃或可燃物、还原剂等分开存放
B.使用时避免与眼睛、皮肤和衣服接触
C.储存于干燥洁净、不通风的仓库内
D.过碳酸钠不慎溅入眼睛应用流动清水或生理盐水冲洗,并就医
(4)过碳酸钠是一种很好的消毒剂,下列与其消毒原理相似的是 。(填字母标号)
A.乙醇 B.漂粉精 C.二氧化硫 D.过氧化钠
(5)工业上常以所含活性氧的质量分数 衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。
衡量过碳酸钠产品的优势,13%以上为优等品。取2g某厂家生产的过碳酸钠样品(所含杂质不参加反应)溶于水配成溶液,加入足量MnO2,反应完全后溶液质量减轻0.264g,则该样品中活性氧的质量分数为 。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江西省新余市高三上学期期末考试理综化学试卷(解析版) 题型:选择题
下列有机物分子中不是所有原子都在同一平面的是
A.溴苯 B.氯乙烯 C.甲苯 D.乙炔
查看答案和解析>>
科目:高中化学 来源:2014-2015学年江苏省南通市高三第一次模拟化学试卷(解析版) 题型:选择题
一定温度下,在三个体积均为2.0 L的恒容密闭容器中发生如下反应:PCl5(g) PCl3(g)+Cl2(g)
PCl3(g)+Cl2(g)
编号 | 温度(℃) | 起始物质的量 (mol) | 平衡物质的量 (mol) | 达到平衡所需时间 (s) | |
PCl5(g) | PCl3(g) | Cl2(g) | |||
Ⅰ | 320 | 0.40 | 0.10 | 0.10 | t1 |
Ⅱ | 320 | 0.80 | t2 | ||
Ⅲ | 410 | 0.40 | 0.15 | 0.15 | t3 |
下列说法正确的是
A.平衡常数K:容器Ⅱ>容器Ⅲ
B.反应到达平衡时,PCl5的转化率:容器Ⅱ<容器Ⅰ
C.反应到达平衡时,容器I中的平均速率为v(PCl5)= mol/(L·s)
mol/(L·s)
D.起始时向容器Ⅲ中充入PCl5 0.30 mol、PCl3 0.45 mol和Cl2 0.10 mol,则反应将向逆反应方向进行
查看答案和解析>>
科目:高中化学 来源:2014-2015学年湖北省枣阳市高三上学期期末考试理综化学试卷(解析版) 题型:填空题
【化学——选修2:化学与技术】(15分)
Ⅰ.合成氨工业的主要反应为:N2(g) + 3H2(g) 2NH3(g) △H<O,下图是合成氨的简要流程示意图:
2NH3(g) △H<O,下图是合成氨的简要流程示意图:

(1)沿X路线进入压缩机的物质是 。
(2)氮、氢混合气体送入合成塔前要通过压缩机压缩的原因是 ;
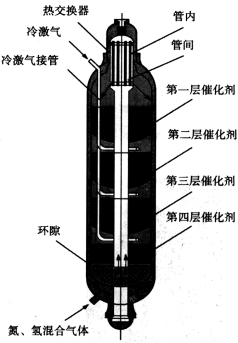
(3)下图为氨合成塔,为什么原料气从塔底流经外筒环隙进入,气体在反应前后都要通过热交换器?
Ⅱ.氨是一种重要的化工原料,能制备氮肥、硝酸和纯碱等。
(1)我国化学家侯德榜改革国外的纯碱生产工艺,采用联合制碱法,生产流程可简要表示如下:

①写出上述流程中X物质的分子式 。
②沉淀池中发生的化学反应方程式是 。
③向母液中通入氨气,加入细小食盐颗粒,冷却析出副产品,通入氨气的作用有 。
a.增大NH4+的浓度,使NH4Cl更多地析出
b.使NaHCO3更多地析出
c.使NaHCO3转化为Na2CO3,提高析出的NH4Cl纯度
(2)某工厂用氨制硝酸,再进一步制NH4NO3。已知由NH3制HNO3时产率为88%,由NH3被HNO3的吸收率为98%。则该工厂用100吨氨最多能制硝酸铵 吨。
查看答案和解析>>
科目:高中化学 来源:2014-2015学年福建省漳州市八校高三第二次联考化学试卷(解析版) 题型:选择题
能正确表示下列反应的离子方程式是
A.醋酸钠的水解反应 CH3COO-+H3O+=CH3COOH+H2O
B.碳酸氢钙与过量的NaOH溶液反应 Ca2++2HCO3-+2OH-=CaCO3↓+2H2O+CO32-
C.向FeBr2溶液中通入过量氯气 2Fe2++Cl2===2Fe3++2Cl-
D.稀硝酸与过量的铁屑反应 3Fe+8H++2NO3-=3Fe3++2NO↑+4H2O
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com