


科目:高中化学 来源: 题型:
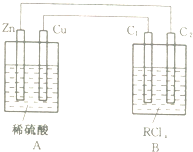 某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.
某金属的氯化物RClx13.5g溶于水配成0.100mol?L-1的水溶液1.00L.取该溶液放入图的B烧杯中,电解一段时间,Cu极上放出11.2毫升(标准状况)气体,B烧杯中C2极的质量增加0.0320g.求金属R的相对原子质量.查看答案和解析>>
科目:高中化学 来源: 题型:
| A、盐酸 氢氧化钠 碳酸钠 硫酸铜 |
| B、盐酸 硝酸银 氯化钠 硝酸钠 |
| C、氢氧化钠 硫酸镁 氯化钠 盐酸 |
| D、氯化钡 硫酸钠 氯化钙 硝酸钙 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、蒸馏、蒸发、萃取、过滤 |
| B、过滤、蒸发、萃取、蒸馏 |
| C、萃取、过滤、蒸馏、蒸发 |
| D、蒸馏、过滤、萃取、蒸发 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量浓硫酸沾在皮肤上,立即用氢氧化钠溶液冲洗 |
| B、蒸馏操作时,应使温度计水银球靠近蒸馏烧瓶支管口处 |
| C、用蒸发方法使NaCl从溶液中析出时,应将蒸发皿中NaCl溶液全部加热蒸干 |
| D、将含硫酸的废液倒入水槽,用水冲入下水道 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 去氢 |
| 加氢 |
| 被氧气氧化 |
| 催化剂 |
| A、A是乙炔,B是乙烯 |
| B、A是乙醇,B是乙醛 |
| C、A是乙烯,B是乙烷 |
| D、A是环己烷,B是苯 |
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| 时间/min | 0 | 5 | 10 | 15 | 20 | 25 | 35 | 50 | 60 | 70 | 80 |
| 温度/℃ | 25 | 26 | 26 | 26 | 26 | 26 | 26.5 | 27 | 27 | 27 | 27 |
| 实验 编号 | 铜片 质量/g | 0.1mol?L-1的 硝酸体积/mL | 硝酸铜 晶体/g | 亚硝酸钠 晶体/g | 实验目的 |
| ① | 5 | 20 | 0 | 0 | 实验①和②探究 |
| ② | 5 | 20 | 0.5 | 0 | |
| ③ | 5 | 20 | 0 | 0.5 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com