
【题目】甲胺(![]() )的性质与氨气相似,将pOH相同、体积均为
)的性质与氨气相似,将pOH相同、体积均为![]() 的CH3NH2H2O和
的CH3NH2H2O和![]() 两种溶液分别加水稀释至体积为V,pOH随
两种溶液分别加水稀释至体积为V,pOH随![]() 的变化关系如图所示,下列叙述错误的是( )
的变化关系如图所示,下列叙述错误的是( )
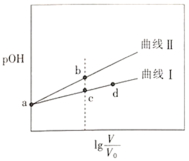
已知:常温下,![]() ,pOH=-lgc(OH-)。
,pOH=-lgc(OH-)。
A.稀释相同倍数时,CH3NH2H2O的浓度比![]() 的浓度大
的浓度大
B.溶液中水的电离程度:b点大于c点
C.由c点到d点,溶液中![]() 保持不变
保持不变
D.常温下,某盐酸的![]() ,a点时CH3NH2H2O的
,a点时CH3NH2H2O的![]() ,当
,当![]() 时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
时,取等体积的两溶液混合,充分反应后:n(Cl-)>n(CH3NH3+)>n(H+)>n(OH-)
【答案】D
【解析】
甲胺(![]() )的性质与氨气相似,则CH3NH2H2O为弱碱。将pOH相同、体积均为
)的性质与氨气相似,则CH3NH2H2O为弱碱。将pOH相同、体积均为![]() 的CH3NH2H2O和
的CH3NH2H2O和![]() 两种溶液分别加水稀释至体积为V,从图中可以看出,稀释相同倍数时,曲线Ⅱ的pOH变化大,则曲线Ⅱ表示NaOH的pOH随
两种溶液分别加水稀释至体积为V,从图中可以看出,稀释相同倍数时,曲线Ⅱ的pOH变化大,则曲线Ⅱ表示NaOH的pOH随![]() 的变化,曲线Ⅰ表示CH3NH2H2O的pOH随
的变化,曲线Ⅰ表示CH3NH2H2O的pOH随![]() 的变化。
的变化。
A.由于CH3NH2H2O为弱碱,当CH3NH2H2O和![]() 的pOH相同时,CH3NH2H2O的浓度大,所以稀释相同倍数时,CH3NH2H2O的浓度比
的pOH相同时,CH3NH2H2O的浓度大,所以稀释相同倍数时,CH3NH2H2O的浓度比![]() 的浓度大,A正确;
的浓度大,A正确;
B.溶液中pOH b点大于c点,则c点溶液中c(OH-)大,对水电离的抑制作用大,所以溶液中水的电离程度:b点大于c点,B正确;
C.溶液中![]() =
=![]() =
=![]() ,由c点到d点,溶液的温度不变,KW、Kb不变,所以保持不变,C正确;
,由c点到d点,溶液的温度不变,KW、Kb不变,所以保持不变,C正确;
D.常温下,当![]() 时,盐酸溶液中的c(H+)与CH3NH2H2O溶液中c(OH-)相等,取等体积的两溶液混合,则反应生成CH3NH3Cl,同时CH3NH2H2O有剩余,CH3NH2H2O继续发生电离而使溶液显碱性,从而得出n(CH3NH3+) n(Cl-)>n(OH-)>n(H+),D错误;
时,盐酸溶液中的c(H+)与CH3NH2H2O溶液中c(OH-)相等,取等体积的两溶液混合,则反应生成CH3NH3Cl,同时CH3NH2H2O有剩余,CH3NH2H2O继续发生电离而使溶液显碱性,从而得出n(CH3NH3+) n(Cl-)>n(OH-)>n(H+),D错误;
故选D。


科目:高中化学 来源: 题型:
【题目】在10 L恒容密闭容器中充入X(g)和Y(g),发生反应X(g)+Y(g) ![]() M(g)+N(g),所得实验数据如下表:
M(g)+N(g),所得实验数据如下表:
实验 编号 | 温度/℃ | 起始时物质的量/mol | 平衡时物质的量/mol | ||
n(X) | n(Y) | n(M) | |||
① | 700 | 0.40 | 0.10 | 0.090 | |
② | 800 | 0.10 | 0.40 | 0.080 | |
③ | 800 | 0.20 | 0.30 | a | |
④ | 900 | 0.10 | 0.15 | b | |
下列说法正确的是( )
A. 实验①中,若5 min时测得n(M)=0.050 mol,则0至5 min时间内,用N表示的平均反应速率v(N)=1.0×10-2 mol·L-1·min-1
B. 实验②中,该反应的平衡常数K=2.0
C. 实验③中,达到平衡时,X的转化率为60%
D. 实验④中,达到平衡时,b>0.060
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)请写出指定物质对应的化学式。消毒剂碘伏中含有碘分子_____________,胶卷中必不可少的感光材料_____________,加碘盐中含有碘酸钾_____________,发酵粉含有小苏打_____________。
(2)化工厂镁着火,不能用二氧化碳灭火,用化学方程式解释__________________________。
(3)电解饱和食盐水是氯碱工业的基础,写出化学方程式__________________________。
(4)稀醋酸处理热水瓶中水垢(主要成分为碳酸钙)的离子方程式__________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铬及其化合物在材料、颜料及超导等方面用途非常广泛。回答下列问题:
(1)基态Cr原子的价电子排布式为__;Cr成为阳离子时首先失去__轨道的电子。
(2)铬与钾均位于第四周期,铬的熔点和沸点均比钾的高,这是因为__。
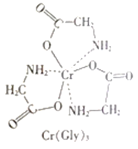
(3)甘氨酸铬(结构如图)是一种配合物,其配位原子是__。
(4)反应:6KSCN+13K2Cr2O7+55H2SO4=13Cr2(SO4)3+6SO2↑+6CO2↑+16K2SO4+55H2O
①KSCN的四种组成元素中第一电离能最大的是__(填元素符号);KSCN中阴离子的空间构型为___形,中心原子的杂化方式是__。
②分子中的大![]() 键可用符号
键可用符号![]() 表示,其中m代表参与形成大
表示,其中m代表参与形成大![]() 键的原子数,n代表参与形成大
键的原子数,n代表参与形成大![]() 键的电子数(如苯分子中的大
键的电子数(如苯分子中的大![]() 键可表示为
键可表示为![]() ),则NO2的大
),则NO2的大![]() 键可表示为__。
键可表示为__。
(5)立方CrO2晶体的结构如图所示,晶胞参数为apm。
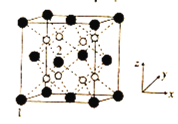
①设NA为阿伏加德罗常数的值,则CrO2的密度为__(列出计算式)g·cm-3。
②1、2号原子的坐标依次为(0,0,0)、(![]() ,0,
,0,![]() ),则原子坐标为(
),则原子坐标为(![]() ,
,![]() ,
,![]() )和(
)和(![]() ,
,![]() ,
,![]() )间的距离为__pm。
)间的距离为__pm。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为确定乙醇分子(C2H6O)中活泼氢原子个数,采用下列装置,通过测定乙醇与金属钠反应放出氢气的多少进行计算。
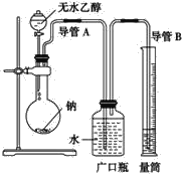
(1)指出实验装置中的错误:__。
(2)若实验中用含有少量水的乙醇代替相同质量的无水乙醇,相同条件下,测得氢气的体积将__(填“偏大”、“偏小”或“不变”)。
(3)请指出能使实验安全、顺利进行的关键实验步骤(至少指出两个关键步骤)__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的定容密闭容器中混合,并在一定条件下发生如下反应:2A(g)+B(g)![]() 2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
2C(g);经2 s后测得C的物质的量浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的这段时间的平均速率为0.3 mol·L-1·s-1
②用物质B表示的这段时间的平均速率为0.6 mol·L-1·s-1
③2 s时物质A的转化率为30%
④2 s时物质B的物质的量浓度为0.3 mol·L-1
其中正确的是
A. ①③ B. ②④ C. ①② D. ③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】9.5 g含杂质的MgCl2溶于水,加足量的AgNO3溶液,得到28 g沉淀。若只含有一种杂质,则杂质不可能是( )
A.NaCl
B.AlCl3
C.CaCl2
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是一个巨大的化学资源宝库,下列有关海水综合利用的说法正确的是( )
A.海水中含有钠元素,只需经过物理变化就可以得到金属钠
B.海水蒸发制得粗盐,经提纯后再电解盐溶液可以得到金属钠
C.从海水中提纯到的食盐,电解饱和食盐水产生的产物可以制得“84”消毒液(NaClO)
D.可以通过物理方法直接从海水中提取溴单质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】4molA和4molB在2L的密闭容器中发生如下反应:2A(g)+B(g)=2C(g)+D(g)。前15s,A的平均反应速率为0.12mol·(L·s)1,则15s时,容器中B的物质的量为( )
A.2.2molB.3.2molC.1.8molD.2.8mol
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com