
【题目】(1)写出N2的电子式_____。下列能实现人工固氮的是____。
A.闪电 B.在加压降温的条件下使空气中的氮气液化
C.根瘤 D.合成氨车间
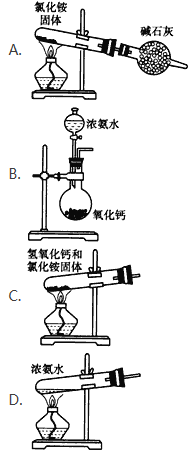
(2)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气。写出该反应的化学方程式____。实验室制取氨气的方法有多种,下面的装置和选用的试剂中错误的是____。
(3)氨气可使湿润的红包石蕊试纸变蓝的原因(用化学用语表示)______。
(4)用乙装置吸收一段时间氨后,再通入空气,同时将加热的铜丝插入乙装置的锥形瓶内,锥形瓶中不可能生成的物质是:____。
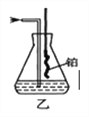
A. H2 B. NO2 C.HNO3 D. NH4N03
写出乙装置中氨催化氧化的化学方程式:______。
(5)已知3Cl2+2NH3→N2+6HCl,常温常压下,在一密闭容器中将15mLCl2和40mLNH3充分反应后,剩余气体的体积为_____mL。
(6)在标准状况下,1L水中可溶解700LNH3,所得溶液的密度为0.9g/cm3,则氨水的物质的量浓度为_____mol/L(保留一位小数)。
【答案】 ![]() D Ca(OH)2+2NH4Cl
D Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O AC NH3+ H2O
CaCl2+2NH3↑+2H2O AC NH3+ H2O![]() NH3· H2O
NH3· H2O![]() NH4++ OH— A 4NH3+5O2
NH4++ OH— A 4NH3+5O2![]() 4NO+6H2O 5 18.4
4NO+6H2O 5 18.4
【解析】(1)N2分子中含有三键,电子式为![]() 。游离态氮元素转化为化合态氮元素的过程是氮的固定,A.闪电是自然固氮,A错误;B.在加压降温的条件下使空气中的氮气液化是物理变化,B错误;C.根瘤菌固氮是自然固氮,C错误;D.合成氨车间属于人工固氮,D正确,答案选D。(2)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气,该反应的化学方程式为Ca(OH)2+2NH4Cl
。游离态氮元素转化为化合态氮元素的过程是氮的固定,A.闪电是自然固氮,A错误;B.在加压降温的条件下使空气中的氮气液化是物理变化,B错误;C.根瘤菌固氮是自然固氮,C错误;D.合成氨车间属于人工固氮,D正确,答案选D。(2)实验室通常用加热消石灰与氯化铵固体的方法来制取氨气,该反应的化学方程式为Ca(OH)2+2NH4Cl![]() CaCl2+2NH3↑+2H2O。A、氯化铵受热分解生成的氯化氢和氨气在试管口又转化为氯化铵,A错误;B、氧化钙溶于水生成氢氧化钙,反应放热,且氢氧根浓度增大,所以可以用浓氨水和生石灰反应制备氨气,B正确;C、试管口应该略低于试管底,C错误;D、直接加热浓氨水可以制备氨气,D正确,答案选AC。(3)氨气溶于水生成一水合氨,一水合氨电离出氢氧根,可使湿润的红包石蕊试纸变蓝,方程式为NH3+ H2O
CaCl2+2NH3↑+2H2O。A、氯化铵受热分解生成的氯化氢和氨气在试管口又转化为氯化铵,A错误;B、氧化钙溶于水生成氢氧化钙,反应放热,且氢氧根浓度增大,所以可以用浓氨水和生石灰反应制备氨气,B正确;C、试管口应该略低于试管底,C错误;D、直接加热浓氨水可以制备氨气,D正确,答案选AC。(3)氨气溶于水生成一水合氨,一水合氨电离出氢氧根,可使湿润的红包石蕊试纸变蓝,方程式为NH3+ H2O![]() NH3· H2O
NH3· H2O![]() NH4++ OH-。(4)氨气与氧气催化氧化生成了一氧化氮和水,一氧化氮能够与氧气生成二氧化氮,二氧化氮与水反应生成一氧化氮和硝酸,硝酸能够与氨气反应生成硝酸铵,所以不可能生成的是氢气,答案选A;氨气催化氧化的反应的方程式为4NH3+5O2
NH4++ OH-。(4)氨气与氧气催化氧化生成了一氧化氮和水,一氧化氮能够与氧气生成二氧化氮,二氧化氮与水反应生成一氧化氮和硝酸,硝酸能够与氨气反应生成硝酸铵,所以不可能生成的是氢气,答案选A;氨气催化氧化的反应的方程式为4NH3+5O2![]() 4NO+6H2O;(5)15ml Cl2和40ml NH3反应,根据反应方程式3Cl2+2NH3=N2+6HCl,15mL氯气反应消耗氨气10mL氨气,生成5mL氮气和30mL氯化氢;由于氨气与氯化氢反应生成氯化铵,剩余的氨气恰好与生成的氯化铵反应,因此最后剩余的气体是氮气,体积为5mL;(6)氨气的物质的量为:700L/22.4L/mol=31.25mol,溶液的质量为:1000g+17×31.25g=1531.25g,氨水溶液的体积为:1531.25g÷0.90.9g/cm3≈1700mL=1.70L,所以氨水的浓度为:31.25mol÷1.7L≈18.4mol/L。
4NO+6H2O;(5)15ml Cl2和40ml NH3反应,根据反应方程式3Cl2+2NH3=N2+6HCl,15mL氯气反应消耗氨气10mL氨气,生成5mL氮气和30mL氯化氢;由于氨气与氯化氢反应生成氯化铵,剩余的氨气恰好与生成的氯化铵反应,因此最后剩余的气体是氮气,体积为5mL;(6)氨气的物质的量为:700L/22.4L/mol=31.25mol,溶液的质量为:1000g+17×31.25g=1531.25g,氨水溶液的体积为:1531.25g÷0.90.9g/cm3≈1700mL=1.70L,所以氨水的浓度为:31.25mol÷1.7L≈18.4mol/L。


 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案科目:高中化学 来源: 题型:
【题目】有以下一系列反应,最终产物为乙二酸。

试回答下列问题:
(1)C的结构简式是______________。
B→C的反应类型是________________,
E→F的化学方程式是___________________。
(2)E与乙二酸发生酯化反应生成环状化合物的化学方程式是__________________。
(3)由B发生水解反应或C与H2O发生加成反应均生成化合物G。在乙二酸、水、苯酚、G四种分子中,羟基上氢原子的活泼性由强到弱的顺序是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数值。下列说法中正确的是( )
A.122.5 g KClO3中含Cl-数目为NA
B.1 mol·L-l的NaOH溶液中含Na+数目为NA
C.标准状况下,22.4L水中含氢原子数目为2NA
D。常温常压下,32 g SO3中含氧原子数目为1.2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物0.1摩和标准状况下的氧气5.6升恰好反应完全,所得产物为CO2、CO、H2O(气),产物通过盛浓硫酸的洗气瓶,洗气瓶的质量增加了5.4克,再通过足量灼热的氧化铜,氧化铜的质量减轻了1.6克,再通过装有碱石灰的干燥管,干燥管增加了8.8克。
(1)求有机物的分子式,
(2)若此有机物能与钠反应,写出其结构简式。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,0.1000mol·L-1NaOH溶液分别滴定20.00mL浓度均为0.1000mol·L-1的两种一元酸HX、HY溶液,滴定曲线如图所示。下列说法正确的是
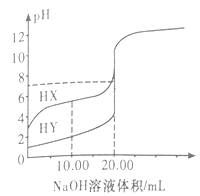
A. HX是强酸,HY是弱酸
B. V[NaOH(aq)]=10.00mL时,
C. V[NaOH(aq)]=20.00mL时,所得的两种溶液的pH均等于7
D. V[NaOH(aq)]=20.00mL时,所得的两种溶液的导电性,HX的比HY的强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是元素周期表的一部分,针对表中的①—⑧八种元素,用元素符号或化学式回答相关问题:

(l)在这些元素中,化学性质最不活泼原子的原子结构示意图为______.
(2)用电子式表示①与③形成化合物的过程______.:
(3)这些元素的最高价氧化物对应的水化物中,酸性最强的是______. ,②、④的最高价氧化物对应水化物的溶液反应的离子方程式为:______.
(4)①②③④四种元素的简单离子半径由大到小的顺序是______.(用离子符号和“>”表示)。
(5)①⑤⑧三种元素的单质沸点由高到低的顺序是______.(用化学式和“>”表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向盛有50mL pH=2的HA溶液的绝热容器中加入pH=13的NaOH溶液,加入NaOH溶液的体积(V)与所得混合溶液的温度(T)的关系如图所示。下列叙述正确的是( )
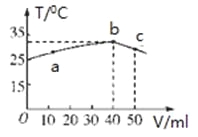
A. HA溶液的物质的量浓度为0.0l mol·L—1
B. b→c的过程中,温度降低的原因是溶液中发生了吸热反应
C. a→b的过程中,混合溶液中可能存在:c(A-)=c(Na+)
D. 25℃时,HA的电离平衡常数K约为1.43×10—2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂废水中含游离态氮,通过下列实验测定其浓度。
①取水样10.0ml于锥形瓶,加入10.0mLKI溶液(足量),滴入指示剂2-3滴。
②取一滴定管依次用自来水,蒸馏水洗净,然后注入0.01mol·L-1的Na2S2O3溶液,调整液面,记下读数。
③将锥形瓶置于滴定管下进行滴定,发生的反应为:I2+2Na2S2O3=2NaI+Na2S4O6。
试回答下列问题:
(1)步骤①加入的指示剂是______________。
(2) 步骤②应使用___________式滴定管。
(3)试描述滴定终点的现象:___________________________。
(4)若耗去Na2S2O3溶液20.00mL,则废水中C12的物质的量浓度为______________。
(5)请指出实验中的一处明显错误:_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中正确的是
A. 已知25℃时NH4CN溶液显碱性,则25℃时的电离平衡常数K(NH3·H2O)>K(HCN)
B. 由水电离出的c(H+)=10-12mol·L-1的溶液中:Na+、Ba2+、HCO3-、Cl-可以大量共存
C. 已知Ksp(AgCl)=1.56×10-10, Ksp(Ag2CrO4)=9.0×10-12。向含有Cl-、CrO42-且浓度均为0.010 mol·L-1溶液中逐滴加入0.010 mol·L-1的AgNO3溶液时,CrO42-先产生沉淀
D. 常温下pH=7的CH3COOH和NaOH混合溶液中,c(Na+)>c(CH3COO-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com