
����Ŀ��(1)��֪��HCN�ĵ��볣��Ka��4.9��10��10��H2S�ĵ��볣��Ka1��1.3��10��7��Ka2��7.0��10��15����NaCN��Һ��ͨ��������H2S���壬��Ӧ�Ļ�ѧ����ʽΪ__________��
(2)��һ�������¿��ü״���CO��Ӧ���ɴ�������CO��Ⱦ�������£���a mol��L��1�Ĵ�����b mol��L��1 Ba(OH)2��Һ�������ϣ���ַ�Ӧ����Һ�д���2c(Ba2��)��c(CH3COO��)����û����Һ�д���ĵ��볣��Ka��_____(�ú�a��b�Ĵ���ʽ��ʾ)��
(3)��֪��25 ��ʱ��H2C2O4�ĵ��볣��Ka1��5.9��10��2��Ka2��6.4��10��5����25 ��ʱ��0.1 mol��L��1NaHC2O4��____�ԣ�������___���������Һ�м���һ����NaOH���壬ʹc(HC2O4-)��c(C2O42-)�����ʱ��Һ��c(H��)=____��
���𰸡�NaCN+H2S=HCN+NaHS ![]() ��10-7L��mol��1 �� HC2O4��ˮ�ⳣ��С�ڵ��볣����HC2O4���ĵ���̶ȴ���ˮ��̶� 6.4��10-5
��10-7L��mol��1 �� HC2O4��ˮ�ⳣ��С�ڵ��볣����HC2O4���ĵ���̶ȴ���ˮ��̶� 6.4��10-5
��������
��1����֪��25��ʱ��HCN�ĵ��볣��K=4.9��10-10��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15��������H2S��HCN��HS��������ǿ���Ʊ��������ͨ��H2S������Ӧ�Ļ�ѧ����ʽ��
��2����Һ������������Ũ�ȼ���һ�룬�������ƽ�ⳣ����Ũ���أ���ϸ�����㣻
��3����Һ�д����ŵ���ƽ��HC2O4��![]() H��+C2O42����ˮ��ƽ�� HC2O4��+H2O
H��+C2O42����ˮ��ƽ�� HC2O4��+H2O![]() H2C2O4+OH������ΪHC2O4���ĵ���̶ȴ���ˮ��̶ȣ�������Һ�����ԣ�NaHC2O4��Һ�����ԣ���Һ��c��H������c��HC2O4����������ƽ�⣺HC2O4��
H2C2O4+OH������ΪHC2O4���ĵ���̶ȴ���ˮ��̶ȣ�������Һ�����ԣ�NaHC2O4��Һ�����ԣ���Һ��c��H������c��HC2O4����������ƽ�⣺HC2O4��![]() H��+C2O42����H2O
H��+C2O42����H2O![]() H��+OH�������ݵ��볣���������㡣
H��+OH�������ݵ��볣���������㡣
��1��25��ʱ��HCN�ĵ��볣��K=4.9��10-10��H2S�ĵ��볣��K1=1.3��10-7��K2=7.0��10-15��������H2S��HCN��HS��������ǿ���Ʊ����ᣬ��NaCN��Һ��ͨ��������H2S���壬�����ķ�ӦΪNaCN+H2S=HCN+NaHS��
��2����Ӧƽ��ʱ��2c��Ba2����=c��CH3COO����=bmol��L��1���ݵ���غ㣬��Һ��c��H����=c��OH����=10-7mol��L��1����Һ�����ԣ��������ƽ�ⳣ�����ݵ��뷽��ʽд��K=![]() =
=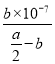 =
=![]() ��10-7���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ
��10-7���ú�a��b�Ĵ���ʽ��ʾ�û����Һ�д���ĵ��볣��Ϊ![]() ��10-7L��mol��1��
��10-7L��mol��1��
��3����Һ�д����ŵ���ƽ��HC2O4��![]() H��+C2O42����ˮ��ƽ�� HC2O4��+H2O
H��+C2O42����ˮ��ƽ�� HC2O4��+H2O![]() H2C2O4+OH����ˮ���ƽ�ⳣ����
H2C2O4+OH����ˮ���ƽ�ⳣ����![]() =
=![]() <Ka2��6.4��10��5����HC2O4���ĵ���̶ȴ���ˮ��̶ȣ�������Һ�����ԣ��������Һ�м���һ����NaOH���壬ʹc��HC2O4����=c��C2O42��������c��H����==
<Ka2��6.4��10��5����HC2O4���ĵ���̶ȴ���ˮ��̶ȣ�������Һ�����ԣ��������Һ�м���һ����NaOH���壬ʹc��HC2O4����=c��C2O42��������c��H����==![]() = Ka2=6.4��10-5��
= Ka2=6.4��10-5��


 ���100�ֵ�Ԫ�Ż�������ϵ�д�
���100�ֵ�Ԫ�Ż�������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���0.10 mol��L��1 KOH��Һ�ζ�10.00 mL 0.10 mol��L-1 H2C2O4(��Ԫ����)��Һ���õζ�������ͼ(�����Һ������ɿ���������Һ�����֮��)������˵����ȷ���ǣ� ��

A.�����ʾ��Һ�У�c(K��)��c(H��)��c(HC2O4-)��c(C2O42-)��c(OH��)
B.�����ʾ��Һ�У�c(K��)��c(HC2O4-)��c��H2C2O4����c(C2O42-)
C.�����ʾ��Һ�У�c(K��)��c(H2C2O4)��c(HC2O4-)��c(C2O42-)��0.10 mol��L-1
D.�����ʾ��Һ�У�c(OH��)= c(H��)+ c(HC2O4-)+ c(C2O42-)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о���ѧ��Ӧ�е������仯����Ҫ���塣�����ѧ����֪ʶ�ش��������⣺
��1����֪һ����̼��ˮ������Ӧ���̵������仯��ͼ��ʾ��

����Ӧ���Ȼ�ѧ����ʽΪ:_______________________________________��
����֪��C��s����H2O��g����CO��g����H2��g����H����131 kJ��mol��1����C��s����CO2��g����2CO��g����H��________��
��2����ѧ��Ӧ����Ϊ�ɼ����Ѻ��¼��γɵĹ��̡���ѧ���ļ������γ��������1 mol��ѧ��ʱ�ͷ���������������������֪��N��N���ļ�����948.9 kJ��mol��1��H��H���ļ�����436.0 kJ��mol��1��N��H���ļ�����391.55 kJ��mol��1����1/2N2��g����3/2H2��g��===NH3��g����H��___________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������Ȼ�ѧ����ʽ�У���ȷ���ǣ� ��
A.�����ȼ����Ϊ890.3kJ��mol-1�������ȼ�յ��Ȼ�ѧ����ʽ�ɱ�ʾΪ��CH4(g)+2O2(g)=CO2(g)+2H2O(g) ��H=-890.3kJ��mol-1
B.500�桢30MPa�£���0.5molN2��1.5molH2�����ܱ������г�ַ�Ӧ����NH3����19.3kJ�����Ȼ�ѧ����ʽΪ��N2(g)+3H2(g)![]() 2NH3(g) ��H = -38.6kJ��mol-1
2NH3(g) ��H = -38.6kJ��mol-1
C.HCl��NaOH ��Ӧ���к�����H= -57.3kJ��mol-1����H2SO4��Ba(OH)2��Ӧ���Ȼ�ѧ����ʽΪ��H2SO4(aq)+Ba(OH)2(aq)=BaSO4(s)+2H2O(l) ��H=-114.6kJ��mol -1
D.��101kPaʱ��2gH2��ȫȼ������Һ̬ˮ���ų�285.8kJ������H2ȼ�յ��Ȼ�ѧ����ʽ��ʾΪ��2H2(g)+O2(g)=2H2O(1) ��H =-571.6kJ��mol-1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ���Ӧ�����������
A.ͼ ��ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ��� Ksp(FeS)<Ksp(CuS)
��ʾһ���¶���FeS��CuS�ij����ܽ�ƽ�����ߣ��� Ksp(FeS)<Ksp(CuS)
B.ͼ ��ʾ�������pH=2�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����<����
��ʾ�������pH=2�ļ�����������Һϡ��ʱ��pH�仯���ߣ������ԣ�����<����
C.ij�¶�����20 mL 0.1 mol��L-1��CH3COOH��Һ����μ���0.1 mol��L-1NaOH��Һ��pH�仯������ͼ��ʾ (�����¶ȱ仯)��������(CH3COO��)>c(Na+)>c(CH3COOH)
(�����¶ȱ仯)��������(CH3COO��)>c(Na+)>c(CH3COOH)
D.ͼ ��ʾ��ӦN2(g)+3H2(g)
��ʾ��ӦN2(g)+3H2(g)![]() 2NH3(g)ƽ��ʱNH3�����������ʼ n��N2��/n��H2���仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
2NH3(g)ƽ��ʱNH3�����������ʼ n��N2��/n��H2���仯�����ߣ���ת���ʣ���A(H2)=��B(H2)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ�������£���3 mol A��1 mol B�����������ڹ̶��ݻ�Ϊ2 L���ܱ������У��������·�Ӧ��3A(g)��B(g) ![]() xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
xC(g)��2D(g)��2 minĩ�÷�Ӧ�ﵽƽ�⣬����0.8 mol D�������C��Ũ��Ϊ0.8 mol��L��1�������жϴ�����ǣ�������
A. x��4 B. 2 min��B�ķ�Ӧ����Ϊ0.1 mol��(L��min)��1
C. ��������ܶȲ��䣬������÷�Ӧ�Ѵﵽƽ��״̬ D. B��ת����Ϊ40%
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������β���ﺬ�е�NO������������ȼ��ȼ�յĸ�����������������Ӧ���£�
N2(g)+O2(g)![]() 2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
2NO(g)����H>0����֪�÷�Ӧ��240����ƽ�ⳣ��K=64��10-4����ش�
(1)ij�¶��£���2L���ܱ������г���N2��O2��1mol��5���Ӻ�O2�����ʵ���Ϊ0.5mol����N2�ķ�Ӧ����Ϊ______��
(2)�ٶ��÷�Ӧ���ں��������½��У��жϸ÷�Ӧ�ﵽƽ��ı�־______��
A.����1molN2ͬʱ����1molO2![]() ��������ܶȲ���
��������ܶȲ���
C.�������ƽ����Է�����������D.2v��(N2)=v��(NO)
(3)��N2��O2�Ļ�����������º����ܱ������У���ͼ�仯������ȷ����______(����ĸ���)��

(4)����º��ݵ��ܱ������г�������ʵ�����N2��O2���ﵽƽ��״̬���������г���һ����NO�����´ﵽ��ѧƽ��״̬![]() ��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______
��ԭƽ��״̬��ȣ���ʱƽ��������NO���������______![]() ���������������С������������
���������������������������![]()
(5)���¶��£�ijʱ�̲��������N2��O2��NO��Ũ�ȷֱ�Ϊ2.5��10-1mol/L��4.0��10-2mol/L��3.0��10-3mol/L����ʱ��Ӧ______(�������ڻ�ѧƽ��״̬������������Ӧ����������������淴Ӧ���������)��������______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��25 ��ʱ��ˮ�ĵ���ﵽƽ�⣺H2O![]() H����OH������H��0������������ȷ����
H����OH������H��0������������ȷ����
A.��ˮ�м�����������NaHSO4��c(H��)����KW����
B.��ˮ�м�������NaOH��Һ��ƽ�������ƶ���c(OH��)����
C.��ˮ�м�������CH3COONa���壬ƽ�������ƶ���c(H��)����
D.��ˮ���ȣ�KW����pH����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ �����н�����ȷ����( )
�����н�����ȷ����( )
A. ���л������ʽΪC13H16 B. ���л������ڱ���ͬϵ��
C. ���л������������4��̼ԭ�ӹ�ֱ�� D. ���л�����������13��̼ԭ�ӹ�ƽ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com