
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )

A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
【答案】C
【解析】
此题考查溶液中的电荷守恒,根据溶液不带电这一特性,溶液中的阳离子和阴离子所带电荷相同,根据所加物质的原子间的关系进行书写物料守恒。
A. 根据电荷守恒得出,点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-),故A不正确,不符合题意。
B. 点③所示溶液中恰好反应生成KHC2O4,该溶液显酸性,故HC2O4-的电离程度大于其水解程度,故c(K+)>c(HC2O4-)>c(C2O42-)>c(H2C2O4),B不正确,不符合题意。
C. 点④所示溶液中,根据物料守恒得出c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1,C正确,符合题意。
D. 点⑤所示溶液为K2C2O4溶液,依据电荷守恒c(K+)+c(H+)=c(HC2O4-)+2c(C2O42-)+c(OH-)和物料守恒c(K+) =2c(H2C2O4)+2c(HC2O4-)+2c(C2O42-),可得溶液中的质子守恒c(OH-)= c(H+)+ c(HC2O4-)+ 2c(H2C2O4),故D答案不正确,不符合题意。
故答案选C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】甲醛是一种重要的化工原料,常用于生产脲醛树脂及酚醛树脂,在木材加工中的地位及其重要。
(1)工业中甲醛的制备方法常用以下几种。
①甲醇氧化法
CH3OH(g)=HCHO(g)+H2(g) △H = +84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H = -484kJ/mol
CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式是_______。
②天然气氧化法
在600-680℃下,使天然气(主要成分是CH4)和空气的混合物通过铁、钼等的氧化物催化剂,直接氧化生成甲醛。反应的化学方程式是_______。
(2)甲醛是污染室内环境的主要污染物,被称为室内污染“第一杀手”。
①去除甲醛有多种方法,其中,催化氧化法是一种比较高效的除甲醛方法。Na-Pt/TiO2催化剂催化氧化甲醛的反应机理如下图所示:
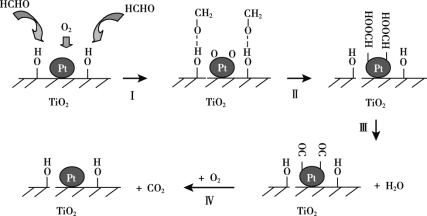
下列有关说法正确的是______(选填字母序号)。
a.该方法除去甲醛的化学方程式是:HCHO+O2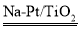 CO2+H2O
CO2+H2O
b.Na-Pt/TiO2催化剂能加快甲醛氧化速率,也能提高甲醛的转化率
c.反应过程中,HCHO只有部分化学键发生断裂
② 为测定居室中甲醛含量,将50L居室中气体缓缓通入25.00mL 0.01molL-1高锰酸钾酸性溶液中,使空气中的甲醛完全吸收,再用0.05molL-1H2C2O4溶液滴定,至终点时消耗H2C2O4溶液12.20mL 。
反应原理为:4MnO4—+12H++5HCHO=4Mn2++5CO2↑+11H2O
2MnO4— +6H++5H2C2O4=2Mn2++10CO2↑+8H2O
滴定终点的现象是_______。该室内空气中甲醛的含量是______mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水的简单装置,下列有关说法正确的是( )
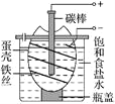
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2molL-1Na2A溶液中滴加0.2molL-1的盐酸,溶液中含A元素的各微粒物质的量如图所示,下列说法错误的是( )
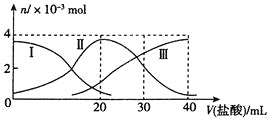
A.Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.2molL-1
B.NaHA溶液的pH<7
C.曲线Ⅰ代表A2-,曲线Ⅲ代表H2A
D.V(盐酸)=30mL时,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为:
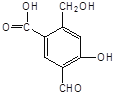
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是____________。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是___________。1molA最多能消耗____________mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:常阻下,Ksp.(ZnS)=1.6×10—24;pM=—lgc(M2+)(MI2+为Cu2+或Zn2+)。常温下,向10 mL 0.10 mol/L CuCl2溶液中滴加0.10 mol/L Na2S溶液,滴加过程中pM与Na2S溶液体积(V)的关系如图所示。下列说法错误的是( )
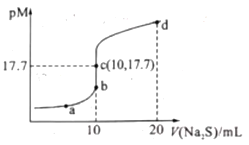
A.Ksp(CuS)的数量级为10-36
B.a点溶液中,c(Na+)=2[c(S2—)+c(HS—)+c(H2S)]
C.d点溶液中:c(Na+)>c(Cl—)>c(S2—)>c(H+)
D.相同条件下,若用等浓度等体积的ZnCl2溶液代替上述CuCl2溶液,则反应终点c向b方向移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
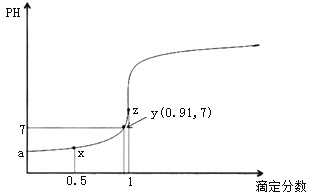
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
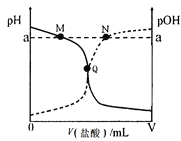
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知:HCN的电离常数Ka=4.9×10-10,H2S的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。向NaCN溶液中通入少量的H2S气体,反应的化学方程式为__________。
(2)在一定条件下可用甲醇与CO反应生成醋酸消除CO污染。常温下,将a mol·L-1的醋酸与b mol·L-1 Ba(OH)2溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(CH3COO-),则该混合溶液中醋酸的电离常数Ka=_____(用含a和b的代数式表示)。
(3)已知:25 ℃时,H2C2O4的电离常数Ka1=5.9×10-2,Ka2=6.4×10-5,则25 ℃时,0.1 mol·L-1NaHC2O4显____性,理由是___,若向该溶液中加入一定量NaOH固体,使c(HC2O4-)=c(C2O42-),则此时溶液中c(H+)=____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com