
【题目】如图为电解饱和食盐水的简单装置,下列有关说法正确的是( )
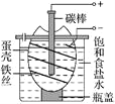
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
【答案】D
【解析】
A.铁电极是阴极,电极反应:2H++2e-═H2↑,碳棒做阳极,电极反应:2Cl--2e-═Cl2↑,在阴极附近产生氢气和大量的氢氧根离子,在阳极附近放氯气和聚集大量的钠离子,蛋壳在该电解池中起到隔膜作用,蛋壳内的溶液无碱性,滴加酚酞,不变红,故A错误;
B.铁电极是阴极,阴极发生得电子的还原反应,故B错误;
C.铁电极是阴极,电极反应:2H++2e-═H2↑,生成的气体不能使湿润的淀粉碘化钾试纸变蓝,故C错误;
D.铁电极是阴极,电极反应:2H++2e-═H2↑,碳棒做阳极,电极反应:2Cl-═Cl2↑+2e-,在阴极附近产生氢气和大量的氢氧根离子,在阳极附近放氯气和聚集大量的钠离子,蛋壳在该电解池中起到隔膜作用,可阻止生成的氯气与氢气、氢氧化钠溶液接触,故D正确;
故答案为:D。


科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 的4种钠盐溶液pH如下:下列说法不正确的是( )
的4种钠盐溶液pH如下:下列说法不正确的是( )
溶质 |
|
| NaClO |
|
pH |
|
|
|
|
A.四种溶液中,![]() 溶液中水的电离程度最大
溶液中水的电离程度最大
B.![]() 溶液显酸性的原因是:
溶液显酸性的原因是:![]()
C.向氯水中加入少量![]() ,可以增大氯水中次氯酸的浓度
,可以增大氯水中次氯酸的浓度
D.常温下,相同物质的量浓度的![]() 、
、![]() 、HClO,pH最小的是
、HClO,pH最小的是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________。
(2)反应②中的能量变化如下图所示,则△H2=______(用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________(写出一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子关系正确的是( )
A.相同温度下,0.2 mol·L-1的醋酸溶液与0.l mol·L-1的醋酸溶液中c(H+)之比大于2 : 1
B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
C.0.l mol﹒L-1NaHSO4溶液中:c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4、浓度均为0.l mol·L-1的CH3COOH、CH3COONa 混合溶液中:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结构的研究是有机化学最重要的研究领域.某有机物X(C12H13O6Br)分子中含有多种官能团,其结构简式如下:(其中Ⅰ、Ⅱ为未知部分的结构).

为推测X的分子结构,进行如图转化:

已知向D的水溶液中滴入FeCl3溶液显紫色,对D的结构进行光谱分析,在氢核磁共振谱上显示只有两种信号.M、N互为同分异构体,M中含有一个六原子环,N能使溴的四氯化碳溶液褪色,G能与NaHCO3溶液反应.请回答:
(1)G分子所含官能团的名称是__;
(2)D不可以发生的反应有(选填序号)__;
①加成反应 ②消去反应 ③氧化反应 ④取代反应
(3)写出上图转化中反应①和②的化学方程式
①B+F→M__;
②G→N__;
(4)已知向X中加入FeCl3溶液,能发生显色反应,则X的结构简式是:___________,1mol该 X与足量的NaOH溶液作用,最多可消耗NaOH__mol;
(5)有一种化工产品的中间体W与G互为同分异构体,W的分子中只含有羧基、羟基和醛基三种官能团,且同一个碳原子上不能同时连有两个羟基.则W的分子结构有__种,写出任意一种的结构简式___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.10 mol·L-1 KOH溶液滴定10.00 mL 0.10 mol·L-1 H2C2O4(二元弱酸)溶液所得滴定曲线如图(混合溶液的体积可看成两者溶液的体积之和),下列说法正确的是( )

A.点②所示溶液中:c(K+)+c(H+)=c(HC2O4-)+c(C2O42-)+c(OH-)
B.点③所示溶液中:c(K+)>c(HC2O4-)>c(H2C2O4)>c(C2O42-)
C.点④所示溶液中:c(K+)+c(H2C2O4)+c(HC2O4-)+c(C2O42-)=0.10 mol·L-1
D.点⑤所示溶液中:c(OH-)= c(H+)+ c(HC2O4-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究化学反应中的能量变化有重要意义。请根据学过的知识回答下列问题:
(1)已知一氧化碳与水蒸气反应过程的能量变化如图所示:

①反应的热化学方程式为:_______________________________________。
②已知:C(s)+H2O(g)=CO(g)+H2(g)ΔH=+131 kJ·mol-1,则C(s)+CO2(g)=2CO(g)ΔH=________。
(2)化学反应可视为旧键断裂和新键形成的过程。化学键的键能是形成(或拆开)1 mol化学键时释放(或吸收)的能量。已知:N≡N键的键能是948.9 kJ·mol-1,H—H键的键能是436.0 kJ·mol-1;N—H键的键能是391.55 kJ·mol-1。则1/2N2(g)+3/2H2(g)===NH3(g)ΔH=___________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com