
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
【答案】3NO(g)+O3(g)===3NO2(g) ΔH=-317.1 kJ·mol-1 否 该反应是焓增、熵减的反应,根据ΔG=ΔH-T·ΔS,ΔG>0 HCOO-+H2O![]() HCOOH+OH- 酸 c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-) 放热 不变 0.25
HCOOH+OH- 酸 c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-) 放热 不变 0.25
【解析】
(1). 考查盖斯定律的计算;(2).从化学反应进度进行分析; (3). 从盐类水解角度分析;(4).考查化学平衡移动和平衡常数计算。
(1). ①NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1 ②2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1,根据盖斯定律,目标反应的反应热等于①+②,所以I的热化学方程式为3NO(g)+O3(g)===3NO2(g) ΔH=-317.1 kJ·mol-1;
(2). 根据ΔG=ΔH-T·ΔS判断反应能否自发进行,2CO(g)===2C(s)+O2(g),该反应是焓变增、熵变减的反应,根据ΔG=ΔH-T·ΔS>0,不能自发进行,故答案为否;
(3). 甲酸钠为强碱弱酸盐,故其中HCOO-水解方程式为HCOO-+H2O![]() HCOOH+OH-;20 mL 0.1 mol·L-1的甲酸钠溶液与10 mL 0.1 mol·L-1的盐酸反应得到等浓度等体积甲酸、甲酸钠和氯化钠混合液,由甲酸的电离常数结合水的离子积可知,甲酸电离程度大于甲酸钠水解程度,故溶液显酸性,离子浓度大小顺序为:c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-);
HCOOH+OH-;20 mL 0.1 mol·L-1的甲酸钠溶液与10 mL 0.1 mol·L-1的盐酸反应得到等浓度等体积甲酸、甲酸钠和氯化钠混合液,由甲酸的电离常数结合水的离子积可知,甲酸电离程度大于甲酸钠水解程度,故溶液显酸性,离子浓度大小顺序为:c(Na+)>c(HCOO-)>c(Cl-)>c(H+)>c(OH-);
(4). ①温度升高NO含量变大,平衡逆向移动,所以正反应是放热反应;②由200℃时,各物质的量关系可以知道,反应方程式为:2NO![]() A+B,两边气体的计量数相等,而平衡后向恒容容器中再充入0.1molNO,相当于增大压强,平衡不移动,所以NO的百分含量将不变;③平衡常数等于平衡时生成物的浓度幂之积比上反应物的浓度幂之积,所以
A+B,两边气体的计量数相等,而平衡后向恒容容器中再充入0.1molNO,相当于增大压强,平衡不移动,所以NO的百分含量将不变;③平衡常数等于平衡时生成物的浓度幂之积比上反应物的浓度幂之积,所以 。
。


科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
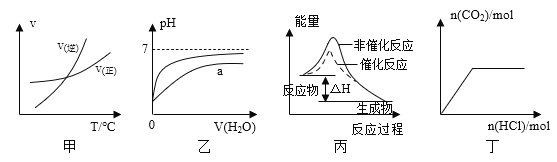
A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醛是一种重要的化工原料,常用于生产脲醛树脂及酚醛树脂,在木材加工中的地位及其重要。
(1)工业中甲醛的制备方法常用以下几种。
①甲醇氧化法
CH3OH(g)=HCHO(g)+H2(g) △H = +84kJ/mol
2H2(g)+O2(g)=2H2O(g) △H = -484kJ/mol
CH3OH(g)与O2(g)反应生成HCHO(g)和H2O(g)的热化学方程式是_______。
②天然气氧化法
在600-680℃下,使天然气(主要成分是CH4)和空气的混合物通过铁、钼等的氧化物催化剂,直接氧化生成甲醛。反应的化学方程式是_______。
(2)甲醛是污染室内环境的主要污染物,被称为室内污染“第一杀手”。
①去除甲醛有多种方法,其中,催化氧化法是一种比较高效的除甲醛方法。Na-Pt/TiO2催化剂催化氧化甲醛的反应机理如下图所示:
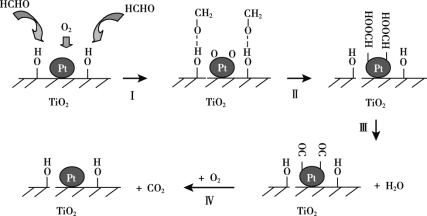
下列有关说法正确的是______(选填字母序号)。
a.该方法除去甲醛的化学方程式是:HCHO+O2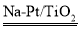 CO2+H2O
CO2+H2O
b.Na-Pt/TiO2催化剂能加快甲醛氧化速率,也能提高甲醛的转化率
c.反应过程中,HCHO只有部分化学键发生断裂
② 为测定居室中甲醛含量,将50L居室中气体缓缓通入25.00mL 0.01molL-1高锰酸钾酸性溶液中,使空气中的甲醛完全吸收,再用0.05molL-1H2C2O4溶液滴定,至终点时消耗H2C2O4溶液12.20mL 。
反应原理为:4MnO4—+12H++5HCHO=4Mn2++5CO2↑+11H2O
2MnO4— +6H++5H2C2O4=2Mn2++10CO2↑+8H2O
滴定终点的现象是_______。该室内空气中甲醛的含量是______mg/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】迷迭香酸是从蜂花属植物中提取得到的酸性物质,其结构如图

下列叙述正确的是( )
A.迷迭香酸属于芳香烃
B.1 mol迷迭香酸最多能和9 mol氢气发生加成反应
C.迷迭香酸可以发生水解反应,取代反应和酯化反应
D.1 mol迷迭香酸最多能和含5 mol NaOH的水溶液完全反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
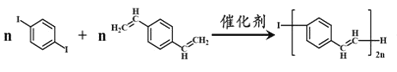 +(2n-1)HI
+(2n-1)HI
A.合成PPV的反应为加聚反应
B.1molPPV最多能与4 molH2发生加成反应
C. 与溴水加成后的产物最多有16个原子共平面
与溴水加成后的产物最多有16个原子共平面
D.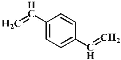 和苯乙烯互为同系物
和苯乙烯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
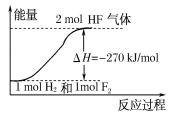
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为电解饱和食盐水的简单装置,下列有关说法正确的是( )
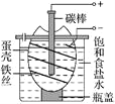
A.电解一段时间后,向蛋壳内的溶液中滴加几滴酚酞,呈红色
B.蛋壳表面缠绕的铁丝上发生氧化反应
C.铁丝表面生成的气体能使湿润的淀粉碘化钾试纸变蓝
D.蛋壳可阻止生成的氯气与氢气、氢氧化钠溶液接触
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20mL0.2molL-1Na2A溶液中滴加0.2molL-1的盐酸,溶液中含A元素的各微粒物质的量如图所示,下列说法错误的是( )
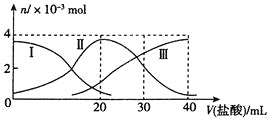
A.Na2A溶液中,c(A2-)+c(HA-)+c(H2A)=0.2molL-1
B.NaHA溶液的pH<7
C.曲线Ⅰ代表A2-,曲线Ⅲ代表H2A
D.V(盐酸)=30mL时,c(Na+)=2c(A2-)+2c(HA-)+2c(H2A)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
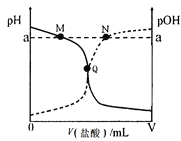
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com