
【题目】下列图示与对应的叙述相符的是
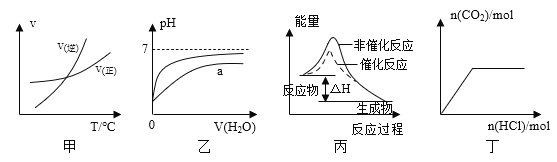
A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
 全能练考卷系列答案
全能练考卷系列答案 一课一练课时达标系列答案
一课一练课时达标系列答案科目:高中化学 来源: 题型:
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物质的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物质的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物质的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入盐酸:
溶液中,逐滴加入盐酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
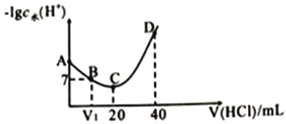
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
C.用饱和氯化铵溶液可以清洗金属表面的锈迹
D.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大,pH增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 的4种钠盐溶液pH如下:下列说法不正确的是( )
的4种钠盐溶液pH如下:下列说法不正确的是( )
溶质 |
|
| NaClO |
|
pH |
|
|
|
|
A.四种溶液中,![]() 溶液中水的电离程度最大
溶液中水的电离程度最大
B.![]() 溶液显酸性的原因是:
溶液显酸性的原因是:![]()
C.向氯水中加入少量![]() ,可以增大氯水中次氯酸的浓度
,可以增大氯水中次氯酸的浓度
D.常温下,相同物质的量浓度的![]() 、
、![]() 、HClO,pH最小的是
、HClO,pH最小的是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于苯的叙述正确的是( )
A.苯的分子式为C6H6,它不能使酸性KMnO4溶液褪色,属于饱和烃
B.从苯的凯库勒式(![]() )看,苯分子中含有碳碳双键,应属于烯烃
)看,苯分子中含有碳碳双键,应属于烯烃
C.在催化剂作用下,苯与液溴反应生成溴苯,发生了加成反应
D.苯分子为平面正六边形结构,6个碳原子之间的价键完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com