
【题目】下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
C.用饱和氯化铵溶液可以清洗金属表面的锈迹
D.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大,pH增大
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】(I)![]() 和
和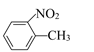 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
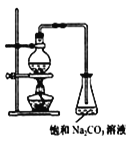
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为:N2O4(g)![]() 2NO2(g)△H=+24.4kJ/mol。
2NO2(g)△H=+24.4kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是_________________(填写代号)。
a.υ正(N2O4)=2υ逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色________(填“变深”、“变浅”或“不变”)判断理由是____________________________________________________________________。
(2)上述反应中,正反应速率υ正=k正·p(N2O4),逆反应速率υ逆=k逆·p2(NO2),其中k正、k逆为速率常数,p(N2O4),p(NO2)为N2O4,NO2的分压,分压=总压×物质的量分数,则Kp为_________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,υ正=___________kPa·s-1。
(3)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为(用α表示)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知NaHSO4在水中的电离方程式为NaHSO4===Na++H++SO42-。某温度下,向c(H+)=1×10-6 mol·L-1的蒸馏水中加入NaHSO4晶体,保持温度不变,测得溶液的c(H+)=1×10-2 mol·L-1。下列对该溶液的叙述不正确的是
A. 该温度高于25℃
B. 由水电离出来的H+的浓度为1×10-10 mol·L-1
C. 加入NaHSO4晶体抑制了水的电离
D. 取该溶液加水稀释100倍,溶液中的c(OH-)减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是
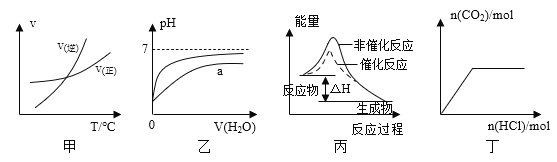
A. 由图甲表示的反应速率随温度变化的关系可知该反应的ΔH>0
B. 图乙表示pH相同的盐酸与醋酸中分别加入水后溶液pH的变化,其中曲线a对应的是醋酸
C. 图丙表示该反应为放热反应,且催化剂能改变反应的焓变
D. 图丁表示向Na2CO3溶液中逐滴滴加稀盐酸,生成CO2与所加盐酸物质的量的关系
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.![]() 时,
时,![]() NaOH溶液和
NaOH溶液和![]()
![]() 混合,若溶液显酸性,则所得溶液中离子浓度可能为:
混合,若溶液显酸性,则所得溶液中离子浓度可能为:![]()
B.取![]() 的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入
的盐酸和醋酸各100mL,分别稀释2倍后,再分别加入![]() 锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
锌粉,在相同条件下充分反应,醋酸与锌反应的速率大
C.用浓盐酸酸化的![]() 溶液与
溶液与![]() 反应,证明
反应,证明![]() 具有还原性:
具有还原性:![]()
D.含等物质的量的![]() 和
和![]() 的溶液中存在:
的溶液中存在:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制备MnO2的装置如图。下列说法错误的是

A. 离子交换膜可选用质子交换膜
B. 阳极反应式为Mn2++2H2O-2e-= MnO2+4H+
C. 阴极区溶液的PH增大
D. 导线中通过1mol电子时,理论上阳极区溶液质量减少44.5g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向10mL 0.1 mol·L—1的HA溶液中逐滴滴入0.1 mol·L—1氨水,所得溶液pH及导电能力变化如图所示。下列分析不正确的是
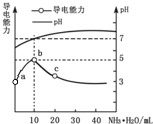
A.HA的电离方程式:HA![]() H+ +A—
H+ +A—
B.a点:c(H+)> c(A—)
C.b点:c(A—) 与c(NH4+)浓度大致相等
D.b~c点的溶液中,所含溶质均能促进水的电离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:H2(g)+F2(g)===2HF(g) ΔH=-270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1 mol H2与1 mol F2反应生成2 mol液态HF放出的热量小于270 kJ
C.在相同条件下,1 mol H2与1 mol F2的能量总和大于2 mol HF气体的能量
D.该反应中的能量变化可用如图来表示
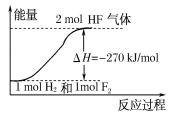
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com