
【题目】(I)![]() 和
和 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
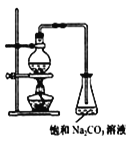
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h
【答案】D 冷凝管、蒸馏烧瓶、温度计、牛角管、锥形瓶、酒精灯 增大乙醇的浓度 移去生成物 原料来不及反应就被蒸出 温度过高,发生了副反应或冷凝效果不好,部分产物挥发了 产生大量的酸性废液(或造成环境污染) 部分原料炭化或催化剂重复使用困难或催化效果不理想 C
【解析】
(I)①两种物质常温下为液体,结构相似,则相互溶解,根据表中数据,其沸点不同,可用蒸馏的方法分离;
②蒸馏时,用到的玻璃仪器由由下到上、由左到右的顺序依次为酒精灯、蒸馏烧瓶、温度计、导管、冷凝管、牛角管、锥形瓶;
II(1)乙醇、乙酸均为反应物,提高乙酸的转化率,可增大乙醇的用量,或及时分离出乙酸乙酯等方法;
(2)乙醇易挥发,在加热的条件下还没反应即挥发,或反应温度高副反应较多导致制备少量的乙酸乙酯,产率往往偏低;
(3)以浓硫酸为催化剂,会产生二氧化硫污染环境、高温时,原材料碳化等;
(4)根据表中数据,温度越高耗能越多,转化率提高不明显。
(I)①两种物质常温下为液体,结构相似,则相互溶解,根据表中数据,其沸点不同,可用蒸馏的方法分离,答案为D;
②蒸馏时,用到的玻璃仪器由由下到上、由左到右的顺序依次为酒精灯、蒸馏烧瓶、温度计、导管、冷凝管、牛角管、锥形瓶;
II(1)乙醇、乙酸均为反应物,提高乙酸的转化率,可增大乙醇的用量,或及时分离出乙酸乙酯等方法;
(2)乙醇易挥发,在加热的条件下还没反应即挥发,或反应温度高副反应较多导致制备少量的乙酸乙酯,产率往往偏低;
(3)以浓硫酸为催化剂,会产生二氧化硫污染环境、高温时,原材料碳化等;
(4)根据表中数据,温度越高耗能越多,转化率提高不明显,则选择60℃,4小时,答案为C。


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )

A.曲线m表示pH与![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-5.7
HCO3-+OH-的平衡常数为1.0×10-5.7
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为__________。
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_____。
③已知CN-与N2互为等电子体,推算HCN分子中σ键与π键数目之比为_____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为________,该单质晶体中原子的堆积方式为四种基本堆积方式中的________。
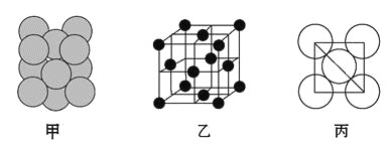
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机化合物X、Y、A、B、C、D、E、F、G之间的转化关系如下所示。

已知以下信息:
①![]()
②![]() (R、R’代表烃基)
(R、R’代表烃基)
③X在催化剂作用下可与H2反应生成化合物Y。
④化合物F的核磁共振氢谱图中只有一个吸收峰。
回答下列问题:
(1)X的含氧官能团的名称是______,X与HCN反应生成A的反应类型是________。
(2)酯类化合物B的分子式是C15H14O3,其结构简式是________________。
(3)X发生银镜反应的化学方程式是______________________________________
(4)G在NaOH溶液中发生水解反应的化学方程式是_________________________
(5) 的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
的同分异构体中:①能发生水解反应;②能发生银镜反应;③能与氯化铁溶液发生显色反应;④含氧官能团处在对位。满足上述条件的同分异构体共有________种(不考虑立体异构),写出核磁共振氢谱图中有五个吸收峰的同分异构体的结构简式____________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下将NaOH溶液添加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
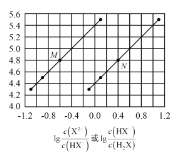
A.Ka2(H2X)的数量级为10-5
B.曲线N表示pH与lg![]() 的变化关系
的变化关系
C.NaHX溶液中c(H+)<c(OH-)
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A.Na与H2O的反应是熵增的放热反应,该反应能自发进行
B.Mg(OH)2固体在溶液中存在平衡:Mg(OH)2(s)![]() Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
Mg2+(aq)+2OH-(aq),该固体可溶于NH4Cl溶液
C.用饱和氯化铵溶液可以清洗金属表面的锈迹
D.在NaHS溶液中,滴入少量CuCl2溶液,产生黑色沉淀,HS-水解程度增大,pH增大
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com