
【题目】25℃时,向Na2CO3溶液中滴入盐酸,混合溶液的pH与离子浓度变化的关系如图所示。已知:lgX=lg![]() 或lg
或lg![]() ,下列叙述正确的是( )
,下列叙述正确的是( )

A.曲线m表示pH与![]() 的变化关系
的变化关系
B.当溶液呈中性时,c(Na+)=c(HCO3-)+2c(CO32-)
C.Ka1(H2CO3)=1.0×10-6.4
D.25℃时,CO32-+H2O![]() HCO3-+OH-的平衡常数为1.0×10-5.7
HCO3-+OH-的平衡常数为1.0×10-5.7
【答案】C
【解析】
A.溶液的pH越小,HCO3-和H2CO3的浓度越大,n曲线代表lg![]() ,m曲线代表lg
,m曲线代表lg![]() ,故A错误;
,故A错误;
B. 当溶液为中性时,溶液中溶质为氯化钠、碳酸氢钠和碳酸,溶液中电荷守恒为c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-)+c(Cl-),则c(Na+)=c(HCO3-)+2c(CO32-)+c(Cl-),故B错误;
C. Ka1(H2CO3)=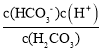 ,在N点lg
,在N点lg![]() =1,即
=1,即![]() =10, c(H+)=10-7.4mol/L,所以Ka1(H2CO3)=10×10-7.4=1.0×10-6.4,故C正确;
=10, c(H+)=10-7.4mol/L,所以Ka1(H2CO3)=10×10-7.4=1.0×10-6.4,故C正确;
D. Ka2(H2CO3)=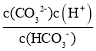 ,在M点lg
,在M点lg![]() =-1,即
=-1,即![]() =0.1,c(H+)=10-9.3mol/L,所以Ka2(H2CO3)=0.1×10-9.3=10-10.3,Kh=
=0.1,c(H+)=10-9.3mol/L,所以Ka2(H2CO3)=0.1×10-9.3=10-10.3,Kh=![]() =
=![]() =1.0×10-3.7,故D错误 ;
=1.0×10-3.7,故D错误 ;
故答案为C。


科目:高中化学 来源: 题型:
【题目】KO2从动力学和热力学的角度来说都是稳定的化合物,为电池的长期稳定性提供了可靠依据。K-O2可充电电池可看作金属钾在负极的电镀和剥离与氧气在正极的还原和生成。“界面”用来阻止电解液的持续降解,电解质为二甲醚的二甲基亚砜(DMSO—DME)溶液,能传导K+。电池反应为:K+O2=KO2,装置如下图所示。下列说法错误的是
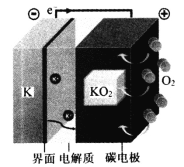
A.放电时,正极反应为K++O2+e-=KO2
B.有效抑制氧气扩散可极大延长K-O2电池的循环性能
C.充电时,每转移1mole-,阳极质量减少39g
D.在理想状态下使用空气来替代纯氧可以降低电池的造价
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对滴有酚酞试液的下列溶液,操作后颜色变深的是
A. 明矾溶液加热 B. CH3COONa溶液加热
C. 氨水中加入少量NH4Cl固体 D. 小苏打溶液中加入少量NaCl固体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A是一种信息材料的添加剂,在相同条件下,A蒸气是同体积氢气质量的88.25倍。在A分子中各元素质量分数分别为w(C)=54.4%,w(H)=7.4%,w(O)=18.1%,w(Cl)=20.1%,A在不同条件下可发生如图所示的一系列变化。
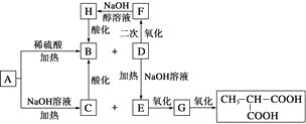
请回答下列问题:
(1)A的分子式为__________。
(2)D分子含有的官能团是________________。
(3)上述转换关系的化学方程式中,属于水解反应的有________个(填数字)。
(4)写出化学方程式:
①A和稀硫酸共热:____________________________________________________;
②E氧化成G:__________________________________________________;
③F与氢氧化钠醇溶液共热:__________________________________________。
(5)与B互为同分异构体的且属于链状酯的物质共有____种。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,某同学设计了一个燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜。下列有关说法正确的是( )

A.反应一段时间后,乙装置中生成的氢氧化钠在铁极区
B.乙装置中铁电极为阴极,电极反应式为Fe-2e-=Fe2+
C.甲中通入氧气的一极为阳极,发生的电极反应为O2+4e-+2H2O=4OH-
D.反应一段时间后,丙装置中硫酸铜溶液浓度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】图所示与对应叙述相符的是
A.  表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS) <Ksp(CuS)
B.  pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C.  表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D.  反应N2(g)+3H2(g)
反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)![]() 和
和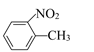 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
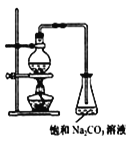
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com