
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
【答案】 羟基 羧基 ![]() 取代反应
取代反应 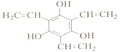
![]()
【解析】 (1) 根据有机物E的结构简式,可知分子中含氧官能团为羟基和羧基,故答案为:羟基、羧基;
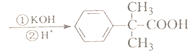
(2 ) 根据反应流程图,对比A、X、C的结构和X的分子式为C14Hl5ON可知,X的结构简式为![]() ,故答案为:
,故答案为:![]() ;
;
(3 ) 对比B、C的结构可知,B中支链对位的H原子被取代生成C,属于取代反应,故答案为:取代反应;
(4 ) F为 。①能与FeCl3溶液发生显色反应,说明苯环上含有羟基;②能使溴水褪色,说明含有碳碳双键等不饱和键;③有3种不同化学环境的氢,满足条件的F的一种同分异构体为
。①能与FeCl3溶液发生显色反应,说明苯环上含有羟基;②能使溴水褪色,说明含有碳碳双键等不饱和键;③有3种不同化学环境的氢,满足条件的F的一种同分异构体为 ,故答案为:
,故答案为: ;
;
(5)以![]() 为原料制备
为原料制备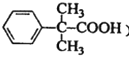 ,需要引入2个甲基,可以根据信息
,需要引入2个甲基,可以根据信息![]() 引入,因此首先由苯甲醇制备卤代烃,再生成
引入,因此首先由苯甲醇制备卤代烃,再生成 ,最后再水解即可,流程图为
,最后再水解即可,流程图为![]()
 ,故答案为:
,故答案为:![]()
 。
。


 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】含氮化合物在生产、生活和科研中有着广泛的应用。
(1)工业上采用NH3为还原剂处理烟气(假设烟气中的NO和NO2的物质的量相等,且反应产物为无毒气体),测量逸出气体中氮氧化物含量,从而确定烟气脱氮率。如图,下列列说法正确的是(填写下列字母编号)

a.相同条件下,改变压强对脱氮率有影响
b.曲线最高点表示此时平衡转化率最高
c.相同条件下,加入不同的催化剂能够改变反应物的转化率
d.上述反应的化学方程式为:NO+NO2+2NH3![]() 2N2
2N2![]() 3H2O
3H2O
(2)已知: 2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
—定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应。反应进行2min时,放出热量21.5kJ,则2min内该反应的反应速率υ(NH3)= ,此时混合气体中NH3的体积分数为 。
(3)在25℃下,将a molL-1的NH4NO3溶液与0.01molL-1的NaOH等体积混合,反应平衡时,测得溶液pH=7,则NH4NO3溶液的物质的量浓度a___________0.01molL-1(填“>”、“<”或“=”);滴加NaOH的过程中水的电离平衡将 (填“正向”、“不”或“逆向”)移动。请你设计实验,比较NH3 H2O的电离程度和NH4NO3的水解程度大小 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于砹(85At)及其化合物的说法中,正确的是 ( )
A. 稳定性:HAt>HCl B. 氧化性:At2>I2
C. At2为分子晶体 D. NaAt的水溶液呈碱性
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是
A. 该过程中CeO2为H2O、CO2 转变为H2、CO的催化剂
B. 该过程实现了太阳能向化学能的转化
C. 1mol CeO2参加反应,共生成2xmol的气体
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3反应生成Al2O3,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。下列有关说法中不正确的是
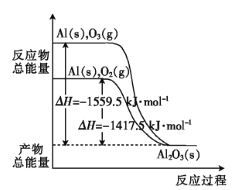
A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH=-1559.5kJ·mol-1
B. 等质量的O2比O3的能量低,O2比O3稳定
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2835kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
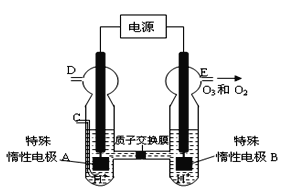
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在里或下能够导电的化合物叫做电解质.电离时,生成的阳离子全部是氢离子(H+)的化合物叫做 .
电离时,生成的阴离子全部是氢氧根离子(OH﹣)的化合物叫做 .
电离时,生成的金属阳离子(或铵根离子NH4+)和酸根离子的化合物叫做 .
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com