
����Ŀ������������������������Ϳ��������Ź㷺��Ӧ�á�
��1����ҵ�ϲ���NH3Ϊ��ԭ���������������������е�NO��NO2�����ʵ�����ȣ��ҷ�Ӧ����Ϊ�����壩�������ݳ������е������ﺬ�����Ӷ�ȷ�������ѵ��ʡ���ͼ��������˵����ȷ����(��д������ĸ���)

a����ͬ�����£��ı�ѹǿ���ѵ�����Ӱ��
b��������ߵ��ʾ��ʱƽ��ת�������
c����ͬ�����£����벻ͬ�Ĵ����ܹ��ı䷴Ӧ���ת����
d��������Ӧ�Ļ�ѧ����ʽΪ��NO��NO2��2NH3![]() 2N2
2N2![]() 3H2O
3H2O
��2����֪�� 2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) ��H=��43.0KJ��mol-1
CO(NH2)2(s)+H2O(g) ��H=��43.0KJ��mol-1
��������������2molNH3��1molCO2�����ݻ�Ϊ2L���ܱ������з�����Ӧ����Ӧ����2minʱ���ų�����21.5kJ����2min�ڸ÷�Ӧ�ķ�Ӧ���ʦ�(NH3)= ����ʱ���������NH3���������Ϊ ��
��3����25���£���a molL-1��NH4NO3��Һ��0.01molL-1��NaOH�������ϣ���Ӧƽ��ʱ�������ҺpH=7����NH4NO3��Һ�����ʵ���Ũ��a___________0.01molL-1������������������������μ�NaOH�Ĺ�����ˮ�ĵ���ƽ�⽫ ����������������������ƶ����������ʵ�����Ƚ�NH3 H2O�ĵ���̶Ⱥ�NH4NO3��ˮ��̶ȴ�С ��
���𰸡���1��ad
��2��0.25molL-1min-1��50%����0.5��
��3�����������������£��������ʵ���Ũ�ȡ�������İ�ˮ���������Һ��ϣ������ҺpH>7����������̶ȴ���ˮ��̶ȣ��������̶�С��ˮ��̶ȣ�������������ɵ÷֣���
��������
�����������1��a����Ϊ�÷�Ӧǰ���������������ȣ����Ըı�ѹǿƽ���ƶ����ѵ��ʱ仯����a��ȷ��b�����������¶ȣ�����������ת����һ��������Ӧ�õ�һ�������������������߱仯���˵���÷�Ӧ��ϵ���д������ڣ�����ߵ���������������b������c������ֻ��Ӱ�컯ѧ��Ӧ���ʣ����ܸı仯ѧƽ��״̬�����ԣ���ͬ�����£����벻ͬ�Ĵ������ܸı䷴Ӧ���ת��������c������d������NH3Ϊ��ԭ�������������������е�NO��NO2�����ʵ�����ȣ��ҷ�Ӧ����Ϊ����������NH3Ϊ��ԭ����NO��NO2Ϊ���������ҷ�Ӧ����ΪN2����Ӧ�Ļ�ѧ����ʽΪ��NO��NO2��2NH3![]() 2N2+3H2O����d��ȷ��
2N2+3H2O����d��ȷ��
��2���ָ�����������μӷ�Ӧ�İ�������n(NH3)=21.5kJ��43.0 kJ/mol��2=1mol����c(NH3)=1mol/2L=0.5mol/L���ٸ��ݷ�Ӧ���ʹ�ʽ����v(NH3)=��c(NH3)/��t=0.5mol/L��2min=0.25molL-1min-1����������ʽ2NH3 +CO2 CO(NH2)2(s)+H2O(g)��֪������1mol�����μӷ�Ӧʱ��������������1mol����ʱ���������NH3���������Ϊ��(2-1)/(2+1-1)��100%=50%����0.5����
��3����25���£�����NH4NO3��Һˮ���̶Ⱥ�С���ʼ��������ԣ�����0.01molL-1��NaOH�������ϣ������ҺpH=7ʱ��NH4NO3��Һ�����ʵ���Ũ��a��0.01molL-1��NH4NO3ˮ���ٽ�ˮ�ĵ��룬�μ�NaOH�Ĺ�����笠�����Ũ����С��ˮ��̶ȼ�С��ˮ�ĵ���ƽ�⽫�����ƶ������Ƚ�NH3H2O�ĵ���̶Ⱥ�NH4NO3��ˮ��̶ȴ�С�������������£��������ʵ���Ũ�ȡ�������İ�ˮ���������Һ��ϣ������ҺpH>7����������̶ȴ���ˮ��̶ȣ��������̶�С��ˮ��̶ȣ�������������ɵ÷֣�������Ϊ�����������������£��������ʵ���Ũ�ȡ�������İ�ˮ���������Һ��ϣ������ҺpH>7����������̶ȴ���ˮ��̶ȣ��������̶�С��ˮ��̶ȣ�������������ɵ÷֣���


 ��ʦ������Ԫ��ĩ���100��ϵ�д�
��ʦ������Ԫ��ĩ���100��ϵ�д� ��У������Ԫͬ��ѵ��������ϵ�д�
��У������Ԫͬ��ѵ��������ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ס�����������ϡ��Һ����pH=a���ҵ�pH=a+1�������ж���ȷ����
A��������ˮ���������H+�����ʵ���Ũ�����ҵ�![]() ��
��
B���ס���������Һ���ʵ���Ũ��֮��Ĺ�ϵΪ��c(��)=10c(��)
C���кͺ��е����ʵ���NaOH����Һ����ס���������������V��֮���ϵΪ��10V(��)>V(��)
D�����е�c(OH-)Ϊ���е�c(OH-)��10��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪Ksp(AgCl)��1.8��10��10��Ksp(AgI)��1.0��10��16������˵���������( )
A��AgCl������ˮ������ת��ΪAgI
B���ں���Ũ�Ⱦ�Ϊ0.001 mol��L��1��Cl����I������Һ�л�������AgNO3ϡ��Һ����������AgI����
C��AgI��AgCl��������ˮ�����ԣ�AgCl����ת��ΪAgI
D�������£�AgCl��Ҫ��NaI��Һ�п�ʼת��ΪAgI����NaI��Ũ�ȱ��벻����![]() ��10��11mol��L��1
��10��11mol��L��1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ú�����г����о���ͬ�¶���ƽ�ⳣ����Ͷ�ϱȼ���ֵ�����⡣
��֪��CO(g)��H2O(g)![]() H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
H2(g)��CO2(g)��ƽ�ⳣ�����¶ȵı仯���±���
�¶�/�� | 400 | 500 | 800 |
ƽ�ⳣ��K | 9.94 | 9 | 1 |
�Իش��������⣺
��1����������Ӧ��________(����ȡ������ȡ�)��Ӧ��
��2����800 �淢��������Ӧ���Ա��е����ʵ���Ͷ����ݷ�Ӧ��������������Ӧ�����ƶ�����________(���±�����ĸ���)��
n(CO) | n(H2O) | n(H2) | n(CO2) | |
A | 1 | 5 | 2 | 3 |
B | 2 | 2 | 1 | 1 |
C | 3 | 3 | 0 | 0 |
D | 0.5 | 2 | 1 | 1 |
��3����֪��һ���¶��£�
C(s)��CO2(g)![]() 2CO(g) ƽ�ⳣ��K1��
2CO(g) ƽ�ⳣ��K1��
C(s)��H2O(g)![]() CO(g)��H2(g) ƽ�ⳣ��K2��
CO(g)��H2(g) ƽ�ⳣ��K2��
CO(g)��H2O(g)![]() H2(g)��CO2(g) ƽ�ⳣ��K��
H2(g)��CO2(g) ƽ�ⳣ��K��
��K��K1��K2֮��Ĺ�ϵ��________��
��4������500 ��ʱ���У�����ʼʱCO��H2O����ʼŨ�Ⱦ�Ϊ0.020 mol��L��1���ڸ������£�COƽ��ʱ��ת����Ϊ______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij�¶�ʱ����n mol��L��1��ˮ����10mL 1.0mol��L��1�����У���ҺpH���¶�����백ˮ����仯������ͼ��ʾ�������й�˵����ȷ������
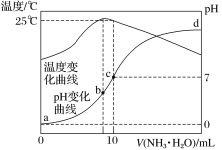
A��a��Kw��1.0��10��14
B��ˮ�ĵ���̶ȣ�c > b >a>d
C��b�㣺c(NH![]() )>c(Cl��)>c(H��)>c(OH��)
)>c(Cl��)>c(H��)>c(OH��)
D��25��ʱ��NH4Clˮ�ⳣ��Kh= ![]() mol��L��1 (����n�Ĵ���ʽ��ʾ)
mol��L��1 (����n�Ĵ���ʽ��ʾ)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��H2��I2��һ���������ܷ�����ӦH2(g)+I2(g)![]() 2HI (g) ��H=-a kJmol-1����֪��
2HI (g) ��H=-a kJmol-1����֪��

����˵������ȷ����
A. ��Ӧ��������������������������
B. ���ܱ������м���2 mol H2��2 mol I2����ַ�Ӧ��ų�������С��2a kJ
C. �Ͽ�2 mol H-I����������ԼΪ(c+b+a) kJ
D. �Ͽ�1 mol H-H����1 mol I-I�������������ڶϿ�2 mol H-I����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������A��B��C��D��E��Fԭ��������������������Ԫ�أ�����λ��Ԫ�����ڱ���ǰ�����ڡ�BԪ�غ���3���ܼ����������ܼ������ĵ����������D��ԭ��������8���˶�״̬��ͬ�ĵ�����EԪ����FԪ������ͬһ�������ڵ��壬���ǵ�ԭ����������3����EԪ�صĻ�̬ԭ����4��δ�ɶԵ�������ش��������⣺
��1����д����D��̬ԭ�ӵļ۲��������ͼ__________��F��̬ԭ������Χ��������ʽ��_________��
��2������˵���������_________��
A.������������Է��������ȶ�����̼�����Էе㣺SiO2>CO2
B.�縺��˳����B<C<D
C.N2��COΪ�ȵ����壬�ṹ������
D.�ȶ��ԣ�H2O>H2S��ˮ�������ȶ���ԭ����ˮ���Ӽ�������
��3��F�����������ڶ���ø�ĸ����ӣ��˹�ģ��ø����ǰ�о����ȵ�����F��������Һ��ͨ�������C��A�γɵ�����X������[F (X)4]2+�������ӵĽṹʽΪ______����Ԫ�ط��ű�ʾ����
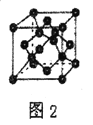
��4��ij��������F(I)��I��ʾ���ϼ�Ϊ+1������γ�ͼ1��ʾ����������������̼ԭ�ӵ��ӻ���ʽ��________��
��5��B���ʵ�һ��ͬ���������������ͼ2��ʾ����һ������������Bԭ����Ϊ_______��
��6��D��F�γ�����������Ϊ1��1�Ļ����������NaCl���ƣ���D���ӵİ뾶Ϊa pm, F���ӵİ뾶b pm����þ����Ŀռ�������________��

�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������VB2)��������ع���ʱ��ӦΪ��4VB2+11O2=4B2O3+2V2O5���øõ�ص��100mL ����ͭ��Һ��ʵ��װ����ͼ��ʾ��b��c��Ϊ���Ե缫)�������·��ͨ��0.02mol����ʱ��Bװ���������ռ���0.224L���壨��״��)������˵����ȷ���ǣ� ��
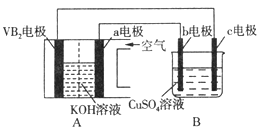
A. �������У�b�缫�������к�ɫ����������Ȼ�������ݲ���
B. VB2Ϊ�������缫��ӦΪ��2VB2+11H2O-22e-=V2O5+2B2O3+22H+
C. ����ڲ�OH-����a�缫����ҺpH��������
D. ������Һ����仯�������Bװ������Һ��pHΪ1
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������Ƕ�(E)�����ڼ��Ἶ���Թ������������֢״����ϳ�·������
(����R-Ϊ )
)

(1) E�е���������������Ϊ___________��___________��
(2) X�ķ���ʽΪC14Hl5ON����X�Ľṹ��ʽΪ___________��
(3) B��C�ķ�Ӧ����Ϊ____________________��
(4) һ�������£�A��ת��ΪF( )��д��ͬʱ��������������F��һ��ͬ���칹��Ľṹ��ʽ��_________��
)��д��ͬʱ��������������F��һ��ͬ���칹��Ľṹ��ʽ��_________��
������FeCl3��Һ������ɫ��Ӧ������ʹ��ˮ��ɫ������3�ֲ�ͬ��ѧ��������
(5)��֪��![]() ��������G(
��������G( )���Ʊ��������Ƕ���һ���м��塣����
)���Ʊ��������Ƕ���һ���м��塣����![]() Ϊԭ���Ʊ�G��д����Ӧ�ĺϳ�·������ͼ�����Լ��������ϳ�·������ͼʾ�������������_______
Ϊԭ���Ʊ�G��д����Ӧ�ĺϳ�·������ͼ�����Լ��������ϳ�·������ͼʾ�������������_______
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com