
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
【答案】A
【解析】
试题分析:A、AgI比AgCl更难溶,反应向着更难溶的方向进行,因此AgCl能转化成AgI,故说法错误;B、Ksp(AgI)=c(Ag+)×c(I-),c(Ag+)=Ksp(AgI)/c(I-)=10-16/0.001mol·L-1=10-13mol·L-1,Ksp(AgCl)=c(Ag+)×c(Cl-),c(Ag+)=Ksp(AgCl)/c(Cl-)=1.8×10-10/0.001mol·L-1=1.8×10-7mol·L-1,因此AgI先沉淀,故说法正确;C、根据选项A的分析,故说法正确;D、AgCl溶液中c2(Ag+)=Ksp(AgCl),c(Ag+)=![]() ×10-5mol·L-1,c(I-)=Ksp/c(Ag+)=
×10-5mol·L-1,c(I-)=Ksp/c(Ag+)= ![]() ×10-11mol·L-1,故说法正确。
×10-11mol·L-1,故说法正确。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】某烷烃的相对分子质量为30,请回答以下问题:
(1)该烷烃的结构简式为_________________;
(2)该烷烃与氯气在光照条件下生成一氯代物,请写出该反应的化学方程式___________________,该反应的反应类型为_______________;
(3)该烷烃可以由含有相同碳原子数的烯烃与氢气反应得到,请写出该反应的化学反应方程式
______________________,该反应的反应类型为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】锂-硫电池由于具有高比能量以及廉价易得等优势受到人们的广泛关注。锂-硫电池的正极材料主要由单质硫和一些高导电性材料复合而成,金属锂片作为负极,正负极之间用浸有电解液的隔膜隔开,其电池结构如图,下列说法不正确的是
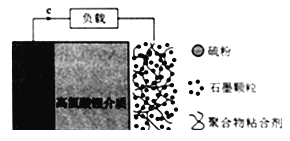
A. 负极的电极反应式为Li-e-=Li+
B. 正极材料中的石墨颗粒主要用于增强导电性
C. 总反应方程式为2Li+S=Li2s
D. 电池工作时电子经导线流向正极,又经高氯酸锂介质流向Li极
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】给定条件下,下列选项中所示的物质间转化均能通过一步反应实现的是( )
A. 0.1 mol L-1 HC1![]() C12
C12 ![]() Ca(ClO)2(aq) B. Al3+
Ca(ClO)2(aq) B. Al3+![]() A1O2-
A1O2- ![]() Al(OH)3
Al(OH)3
C. A1![]() NaA1O2(aq)
NaA1O2(aq) ![]() NaAlO2(s) D. MgO(s)
NaAlO2(s) D. MgO(s) ![]() Mg(NO3)2(aq)
Mg(NO3)2(aq) ![]() Mg(s)
Mg(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是 ( )
A. 将AlCl3溶液和Al2(SO4)3溶液分别加热、蒸干、灼烧,所得固体成分相同
B. 配制FeSO4溶液时,将FeSO4固体溶于稀盐酸中,然后稀释至所需浓度
C. 用分液的方法分离乙醇和水的混合溶液
D. 洗涤油污常用热的Na2CO3溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NA为阿伏伽德罗常数的值,下列说法正确的是
A. 20gD2O中含有的中子数为8NA
B. 3.36LNO2 与足量的水充分反应后,生成0.05NA 个NO 分子
C. 1mol 碳酸钠和碳酸氢钠的混合物中碳酸根离子的数目为NA
D. 3mol 单质Fe 完全燃烧转变为Fe3O4,失去8NA 个电子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含氮化合物在生产、生活和科研中有着广泛的应用。
(1)工业上采用NH3为还原剂处理烟气(假设烟气中的NO和NO2的物质的量相等,且反应产物为无毒气体),测量逸出气体中氮氧化物含量,从而确定烟气脱氮率。如图,下列列说法正确的是(填写下列字母编号)

a.相同条件下,改变压强对脱氮率有影响
b.曲线最高点表示此时平衡转化率最高
c.相同条件下,加入不同的催化剂能够改变反应物的转化率
d.上述反应的化学方程式为:NO+NO2+2NH3![]() 2N2
2N2![]() 3H2O
3H2O
(2)已知: 2NH3(g)+CO2(g)![]() CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
CO(NH2)2(s)+H2O(g) △H=-43.0KJ·mol-1
—定条件下,将2molNH3和1molCO2充入容积为2L的密闭容器中发生反应。反应进行2min时,放出热量21.5kJ,则2min内该反应的反应速率υ(NH3)= ,此时混合气体中NH3的体积分数为 。
(3)在25℃下,将a molL-1的NH4NO3溶液与0.01molL-1的NaOH等体积混合,反应平衡时,测得溶液pH=7,则NH4NO3溶液的物质的量浓度a___________0.01molL-1(填“>”、“<”或“=”);滴加NaOH的过程中水的电离平衡将 (填“正向”、“不”或“逆向”)移动。请你设计实验,比较NH3 H2O的电离程度和NH4NO3的水解程度大小 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于砹(85At)及其化合物的说法中,正确的是 ( )
A. 稳定性:HAt>HCl B. 氧化性:At2>I2
C. At2为分子晶体 D. NaAt的水溶液呈碱性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com