
【题目】某烷烃的相对分子质量为30,请回答以下问题:
(1)该烷烃的结构简式为_________________;
(2)该烷烃与氯气在光照条件下生成一氯代物,请写出该反应的化学方程式___________________,该反应的反应类型为_______________;
(3)该烷烃可以由含有相同碳原子数的烯烃与氢气反应得到,请写出该反应的化学反应方程式
______________________,该反应的反应类型为_______________。
科目:高中化学 来源: 题型:
【题目】常温下,如果取0.1mol/LHA溶液与0.1mol/LNaOH溶液等体积混合(忽略混合后溶液体积的变化),测得混合溶液的pH=8。试回答下列问题:
(1)混合溶液pH=8的原因是 (用离子方程式表示)
(2)混合溶液中由水电离出的c(OH-) (填“大于”、“等于”或“小于”)0.1mol/LNaOH溶液中由水电离出的c(OH-)
(3)求出混合溶液中下列算式的精确计算结果(填具体数字):
c(Na+)- c(A-)= mol/L, c(OH-)- c(HA)= mol/L
(4)常温下,将PH=2的酸HA溶液与PH=12的NaOH溶液等体积混合后,所得溶液PH 7 (填“大于”、“等于”或“小于”)
(5)已知NH4A溶液为中性,又知HA溶液加到Na2CO3溶液中有气体放出,试推断(NH4)2CO3溶液的PH 7(填“大于”、“等于”或“小于”);将同温度下等浓度的下列四种盐溶液按PH由大到小的顺序排列是 (填序号)
A.NH4HCO3 B.NH4A C.(NH4)2SO4 D.NH4Cl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,描述正确的是( )

A. 反应开始到10 s,用Z表示的反应速率为0.158 mol/(L·s)
B. 反应开始到10 s,X的物质的量浓度减少了0.79 mol/L
C. 反应的化学方程式为:X(g)+Y(g)![]() 2Z(g)
2Z(g)
D. 反应进行到10 s后,该反应停止进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子一定能大量共存的是 ( )
A.在含有大量Al3+的无色溶液中:Cu2+、Na+、Cl-、SO42-
B.在含有大量H+ 的 溶液中:Na+、K+、CO32-、NO3-
C.在强酸的溶液中:NH4+、Na+、SO42-、Cl-
D.在滴加石蕊显蓝色的溶液中:K+、Cu2+、Cl-、NO3-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素R、X、Y、Z的原子序数依次增大, a、b、c、d是这4种元素的单质(a、b、c、d顺序不与R、X、Y、Z对应),a为生活中常见的金属,厨房中常见a金属合金餐具和器具。在甲的溶液中通入丙气体,产生白色沉淀,它们之间转化关系如图所示。
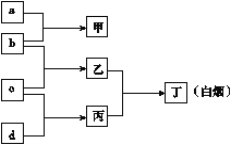
回答下列问题:
(1)写出Z元素在元素周期表中的位置______________________;
(2)写出物质丙的电子式__________________;
(3)X、Y、Z元素简单离子的半径由大到小排列的顺序为(用离子符号表示)______________;
(4)写出Y元素的氢氧化物与NaOH溶液反应的离子方程式______________________________;
(5)As(砷)与X是同族元素,位于第四周期,请写出砷原子的原子结构示意图____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】H、N、O、Na、S、Cl都是中学化学中的常见元素,根据题意回答与这些元素有关的问题:
(1)画出Na原子结构示意图_______,Na2O2可用作供氧剂,其电子式为_______。
(2)Cl2是一种大气污染物,装有液氯的钢瓶上应贴的标签是_______(填编号)。

氯气泄漏可用NaHSO3溶液来处理,写出相关的离子反应方程式_____________。
(3)25C时,利用pH试纸测得0.1mol/L氨水的pH约为11,则可以估算出氨水的电离常数约为_____;向10mL此溶液中通入少量氨气,忽略溶解过程中溶液温度和体积的微小变化,溶液中![]() 将_______(填“增大” “减小”或“无法确定”)。
将_______(填“增大” “减小”或“无法确定”)。
(4)有两种化合物同时含有上述六元素中的四种元素。将这两种化合物的溶液混合后,恰好完全反应,生成物之一M仍含有这四种元素,该反应的离子方程式为______________。若M溶液的pH =5,则由水电离出的c(H+)=_______mol/L,该溶液离子浓度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氢气是一种清洁能源,氢气的制取与储存是氢能源利用领域的热点。
(1) NaBH4是一神重要的储氢载体,能与水反应生成NaBO2,且反应前后B的化合价不变,该反应的化学方程式为_________,反应消耗1molNaBH4时转移的电子数目为___________。
(2) H2S热分解可制氢气。反应方程式:2H2S(g)=2H2(g)+S2(g) △H;在恒容密闭容器中,测得H2S分解的转化率(H2S起始浓度均为c mol/L)如图1所示。图l中曲线a表示H2S的平衡转化率与温度的关系,曲线b表示不同温度下反应经过相同时间且未达到化学平衡时H2S的转化率。

①△H ______0(填“>”“<”或“=”);
②若985℃时,反应经t min达到平衡,此时H2S的转化率为40%,则t min内反应速率v(H2)=_____(用含c、t的代数式表示);
③请说明随温度升高,曲线b向曲线a接近的原因____________。
(3) 使用石油裂解的副产物CH4可制取H2,某温度下,向体积为2L的密闭容器中充入0.40mol CH4(g)和0.60molH2O(g)的浓度随时间的变化如下表所示:

①写出此反应的化学方程式_________,此温度下该反应的平衡常数是_________。
②3 min时改变的反应条件是_________(只填一种条件的改变)。
③一定条件下CH4的平衡转化率与温度、压强的关系如图2所示。则P1_________P2填“>”、“<”或“=“)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两杯醋酸稀溶液,甲的pH=a,乙的pH=a+1,下列判断正确的是
A.甲中由水电离出来的H+的物质的量浓度是乙的![]() 倍
倍
B.甲、乙两杯溶液物质的量浓度之间的关系为:c(甲)=10c(乙)
C.中和含有等物质的量NaOH的溶液,需甲、乙两杯酸的体积(V)之间关系为:10V(甲)>V(乙)
D.甲中的c(OH-)为乙中的c(OH-)的10倍
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16。下列说法错误的是( )
A.AgCl不溶于水,不能转化为AgI
B.在含有浓度均为0.001 mol·L-1的Cl-、I-的溶液中缓慢加入AgNO3稀溶液,首先析出AgI沉淀
C.AgI比AgCl更难溶于水,所以,AgCl可以转化为AgI
D.常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度必须不低于![]() ×10-11mol·L-1
×10-11mol·L-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com