
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
【答案】(1)①2Fe3++2e-=2Fe2+、Cu-2e-=Cu2+②FeCl3、CuCl2③阳
(2)①氧化、2I--2e-=I2、还原、2Fe3++2e-=2Fe2+
②正、I2+2e-=2I-(3)O2+4e-+4H+=2H2O
【解析】
试题分析:(1)①原电池中正极得到电子,则根据方程式可知正极是铁离子得到电子,正极电极反应式为2Fe3++2e-=2Fe2+;负极是铜失去电子,电极反应式为Cu-2e-=Cu2+。
②图中碳棒是正极,铜棒是负极,因此X溶液是FeCl3,Y溶液是CuCl2。
③原电池工作时溶液中的阳离子向正极移动,因此盐桥中的阳离子向X溶液方向移动。
(2)①碘离子失去电子,则乙中石墨是负极,所以反应开始时,乙中石墨电极上发氧化反应,电极反应式为2I--2e-=I2。甲中石墨电极上发生还原反应,电极反应式为2Fe3++2e-=2Fe2+。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,平衡向逆反应方向进行,则乙中的石墨正极,该电极的电极反应式为I2+2e-=2I-。
(3)根据方程式可知氧气得到电子,所以氧气在正极放电,溶液显酸性,则电极反应式为O2+4e-+4H+=2H2O。


 课程达标测试卷闯关100分系列答案
课程达标测试卷闯关100分系列答案 新卷王期末冲刺100分系列答案
新卷王期末冲刺100分系列答案 全能闯关100分系列答案
全能闯关100分系列答案科目:高中化学 来源: 题型:
【题目】H2和I2在一定条件下能发生反应H2(g)+I2(g)![]() 2HI (g) △H=-a kJmol-1,已知:
2HI (g) △H=-a kJmol-1,已知:

下列说法不正确的是
A. 反应物的总能量高于生成物的总能量
B. 向密闭容器中加入2 mol H2和2 mol I2,充分反应后放出的热量小于2a kJ
C. 断开2 mol H-I键所需能量约为(c+b+a) kJ
D. 断开1 mol H-H键和1 mol I-I键所需能量大于断开2 mol H-I键所需能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
Na2O2(s)+CO2(g)=Na2CO3(s)+![]() O2(g) ΔH=-266 kJ·mol-1
O2(g) ΔH=-266 kJ·mol-1
根据以上热化学方程式判断,下列说法正确的是( )
A.CO的标准燃烧热为283 kJ
B.下图可表示由CO生成CO2的反应过程和能量关系
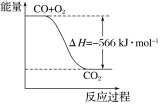
C.2Na2O2(s)+2CO2(s)=2Na2CO3(s)+O2(g) ΔH>-532 kJ·mol-1
D.CO(g)与Na2O2(s)反应放出549 kJ热量时,电子转移数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和对应用途的描述均正确的是
A. SiO2硬度大,可用于制造光导纤维
B. 碳具有还原性,可用碳在高温下将二氧化硅还原为硅
C. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
D. 汽油是常见的有机溶剂,可以用裂化汽油来萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素,用化学符号回答下列问题。

(1)元素J在周期表中的位置是____________。
(2)元素G和元素I对应的最高价氧化物的水化物之间能发生化学反应,试写出该反应的离子方程式____________。
(3)在A~J中,原子半径最大的是_______,最活泼的非金属是_______,最高价氧化物的水化物中酸性最强的是_______。
(4)在G和H中化学性质比较活泼的是_______,请设计化学实验加以证明_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
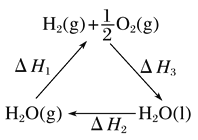
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 在食品袋中放入CaCl2·6H2O,可防止食物受潮
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. SO3溶于水形成的溶液能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
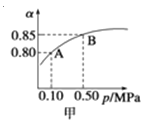
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,v正 和v逆 都增大
D.增大SO2浓度,v正 增大v逆 减小
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com