
【题目】已知反应:2SO2(g)+O2(g)![]() 2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
2SO3(g)△H<0.某温度下,将2mol SO2和1mol O2置于10L密闭容器中,反应达平衡后,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是 ( )
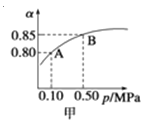
A.由图甲知,A点SO2的平衡浓度为0.4 mol/L
B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2:1:2
C.达平衡后,缩小容器容积,v正 和v逆 都增大
D.增大SO2浓度,v正 增大v逆 减小
 智慧小复习系列答案
智慧小复习系列答案科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____.

(2)第一组实验中褪色时间更长的是:_____(填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________。

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______。待到______,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为__________。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______(填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫玻亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500mL1molL-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要______、________。
(2)步骤②加入过量氯水后发生反应的离子方程式为______.
(3)步骤④中一系列操作步骤为过滤、洗涤、______、冷却、称量。
(4)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1molL-1的硫酸溶液,过滤.取滤液加______溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有______性(填“氧化”或“还原”)的物质.
(5)下列检验(4)中滤液中是否有Fe2+应选用的试剂是______.
A.KSCN溶液B.酸性KMnO4溶液 C.铁粉D.FeCl3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在里或下能够导电的化合物叫做电解质.电离时,生成的阳离子全部是氢离子(H+)的化合物叫做 .
电离时,生成的阴离子全部是氢氧根离子(OH﹣)的化合物叫做 .
电离时,生成的金属阳离子(或铵根离子NH4+)和酸根离子的化合物叫做 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】树脂交联程度决定了树脂的成膜性。下面是一种成膜性良好的醇酸型树脂的合成路线,如下图所示:

(1)合成A的化学方程式是__________。
(2)B的分子式为C4H7Br,且B不存在顺反异构,B的结构简式为_______,A到B步骤的反应类型是_________。
(3)E中含氧官能团的名称是______,D 的系统命名为_________。
(4)下列说法正确的是_______。
A.lmol化合物C最多消耗3molNaOH
B.lmol化合物E与足量银氨溶液反应产生2molAg
C. F不会与Cu(OH)2悬浊液反应
D.丁烷、1-丁醇、化合物D中沸点最高的是丁烷
(5)写出D、F在一定条件下生成醇酸型树脂的化学方程式__________。
(6) 的符合下列条件的同分异构体有_____种。
的符合下列条件的同分异构体有_____种。
① 苯的二取代衍生物;② 遇FeCl3溶液显紫色;③ 可发生消去反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有CuO,Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有( )
A.4个
B.5个
C.6个
D.7个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z三种气体,取X和Y按1∶1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y![]() 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3∶2,则Y的转化率最接近于( )
A. 33% B. 40% C. 50% D. 65%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于有机物的说法正确的是
A. 甲烷与氯气发生取代反应,只能生成一氯甲烷
B. 乙醇和乙酸都可以与钠反应生成氢气
C. 苯和乙烯均能与溴水发生加成反应使溴水褪色
D. 甲醛易溶于水,其水溶液具有杀菌消毒作用,可用于浸泡海鲜食品
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com