
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ����������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʡ�ʵ�鲽�����£�

��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500mL1molL-1��������Һ��������ʱ�õ����������ձ���500mL����ƿ�⣬����Ҫ______��________��
��2������ڼ��������ˮ������Ӧ�����ӷ���ʽΪ______��
��3���������һϵ�в�������Ϊ���ˡ�ϴ�ӡ�______����ȴ��������
��4��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL-1��������Һ�����ˣ�ȡ��Һ��______��Һ����Һ���˵���ò�Ѫ���Ѳ��ֱ��ʣ����ɫ�����Һ�м����֭����Һ��ɫ��ȥ��˵����֭������______�ԣ����������ԭ���������ʣ�
��5�����м��飨4������Һ���Ƿ���Fe2+Ӧѡ�õ��Լ���______��
A��KSCN��ҺB������KMnO4��Һ C������D��FeCl3��Һ��
���𰸡� ������ ��ͷ�ι� 2Fe2++Cl2=2Fe3++2Cl- ���� KSCN ��ԭ B
����������1����Һ����ʱ�õ����������ձ���500mL����ƿ�⣬����Ҫ�ӿ��ܽ⣬�������õIJ�����������ݵμ�ˮ���̶ȵĽ�ͷ�ιܣ�
��2������ڼ��������ˮ������Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
��3��������ǵõ��������������Ĵ��ڹ��̣�����һϵ�в�������Ϊ���ˡ�ϴ�ӡ����ա���ȴ��������
��4�����ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL-1��������Һ�����ˣ�ȡ��Һ��KSCN��Һ����Һ���˵���ò�Ѫ���Ѳ��ֱ��ʣ����ɫ�����Һ�м����֭����Һ��ɫ��ȥ��˵����֭�����л�ԭ�ԣ�
��5�����ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL-1��������Һ�����ˣ�ȡ��Һ������Һ���Ƿ���Fe2+Ӧѡ�õ��Լ����������Ҿ�������������Լ�����Ϊ��Һ�к��������Ӻ��������ӣ�A��KSCN��Һ���벻�ܼ����������Ӵ��ڣ���A�����ϣ�B������KMnO4��Һ������������ӷ�Ӧ��ɫ����֤���������ӵĴ��ڣ���B���ϣ�C�����ۼ��뺬�������������������Ӳ���֤���������ӵĴ��ڣ���C�����ϣ�D��FeCl3��Һ���ܼ����������ӵĴ��ڣ���D�����ϣ��ʴ�ΪB��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʺͶ�Ӧ��;����������ȷ����
A. SiO2Ӳ�ȴ�����������ά
B. ̼���л�ԭ�ԣ�����̼�ڸ����½��������軹ԭΪ��
C. ͭ�Ľ�����Ա�����������ͭ������������Ũ����
D. �����dz������л��ܼ����������ѻ���������ȡ��ˮ�е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����б�����ȷ����
A. ��ʳƷ���з���CaCl2��6H2O���ɷ�ֹʳ���ܳ�
B. ��������̫���ܵ�صij��ò���
C. �����������׳�����,���������ᡢ��ɫͿ��
D. SO3����ˮ�γɵ���Һ�ܵ��磬����SO3�ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������ȷ����
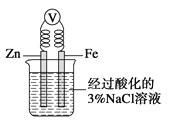
A. ��һС��ͭƬ����ʢ��Ũ������Թ��м��ȷ�Ӧ�����Һ����ɫ
B. ��һС���Ʒ���ʢ��ˮ���ձ��У�����ˮ�����ζ���ͬʱ�����ձ��ڵ���Һ��Ϊ��ɫ
C. ��ͼ��һ��ʱ�����ձ��ڵ���Һ�м�������������Һ���ɿ���Fe�缫�����к��ɫ��������
D. ��ʢ������Mg(OH)2��������Һ���Թ��еμ��Ȼ����Һ���ɿ��������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���������߷ֱ��ʾԪ�ص�ij��������˵�����Ĺ�ϵ(ZΪ�˵������YΪԪ�ص��й�����)����������Ԫ���йص�������������߱��������Ӧ�Ŀո��С�

�٢�A��Ԫ�ص�����������__________��
�ڵ�������Ԫ�ص��������__________��
��F����Na����Mg2����Al3�������Ӱ뾶__________��
��2����A+��B����C2����D�ֱ��ʾ����18���ӵ�4���������ӻ���ӣ�
��A+��B����C2���뾶�ɴ�С˳��Ϊ__________���������ӷ��ţ�
��D�����к���4��ԭ�ӣ������ʽ��______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ��(�ܼ�)��DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3����E��D����ͬһ���壻Fλ��ds������ԭ�ӵ������ֻ��1�����ӡ�
(1)E+���ӵĵ����Ų�ʽ�� ��
(2)B��C��DԪ�صĵ�һ�������ɴ�С��˳���� ��
(3)B��CԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��Ļ�ѧʽ�� ��B��C����Щ�⻯��ķе����ϴ����Ҫԭ���� ��
(4)A��B��D���γɷ���ʽΪA2BD��ij�������û����������Bԭ�ӵĹ���ӻ������� ��1 mol�÷����к�����������Ŀ�� ��

(5)C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ�� ��Cԭ�ӵ���λ���� ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��Ӧ��2SO2��g��+O2��g��![]() 2SO3��g����H��0��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ����ʾ��������˵����ȷ���� ( )
2SO3��g����H��0��ij�¶��£���2mol SO2��1mol O2����10L�ܱ������У���Ӧ��ƽ���SO2��ƽ��ת���ʣ���������ϵ��ѹǿ��p���Ĺ�ϵ��ͼ����ʾ��������˵����ȷ���� ( )
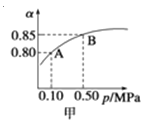
A����ͼ��֪��A��SO2��ƽ��Ũ��Ϊ0.4 mol/L
B����ͼ��֪��B��SO2��O2��SO3��ƽ��Ũ��֮��Ϊ2��1��2
C����ƽ�����С�����ݻ���v�� ��v�� ������
D������SO2Ũ�ȣ�v�� ����v�� ��С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����л������У�ͬ���칹����Ŀ���ٵ��ǣ� ��
A. ���� B. ���� C. 1-�ȼ��� D. ��������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������Ԫ�ذ��������������ڡ��ǡ�
(1)�������ͬ��������ܶ࣬�������б������͵�б�������ⶨ����������ĵ��ʶ�����S8���ɵġ�S8���ӵĹ�����ͼ��ʾ��S��S���ļ���Ϊ108�㣬8��Sԭ���γ����㣬ÿ��4��Sԭ�ӡ�S8������Sԭ��ͨ�� �ӻ�������ԭ�ӳɼ���б������͵�б������S8����֮�俿 �����һ��

(2)��������ͬ���ڵ�̼������������ԭ�ӵĵ�һ�������ɴ�С��˳����____________��
(3) ��Ԫ��ԭ�ӵ縺�Ե������ж�,H2O�е�O��H���ļ��� (�>������=����<��)H2S�е�S��H���ļ��ǡ�
(4)�����������������ȱ�ٵ���Ԫ�أ����������ܹ���ǿ�������������ӻ�˥�ϣ���������ڵ��к����ʡ���ͼ����(Se)����(Sr)�ľ���ģ�ͣ��ݴ˿�֪��ÿ�������Ⱦ����к��е�������Ϊ___________�����仯ѧʽΪ ��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com