
【题目】(1)下列曲线分别表示元素的某种性质与核电荷数的关系(Z为核电荷数,Y为元素的有关性质)。把与下面元素有关的性质相符的曲线标号填入相应的空格中。

①ⅡA族元素的最外层电子数__________。
②第三周期元素的最高正价__________。
③F-、Na+、Mg2+、Al3+的离子半径__________。
(2)用A+、B-、C2-、D分别表示含有18电子的4种微粒(离子或分子)
①A+、B-、C2-半径由大到小顺序为__________。(填离子符号)
②D分子中含有4个原子,其电子式是______。
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是
A. 该过程中CeO2为H2O、CO2 转变为H2、CO的催化剂
B. 该过程实现了太阳能向化学能的转化
C. 1mol CeO2参加反应,共生成2xmol的气体
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
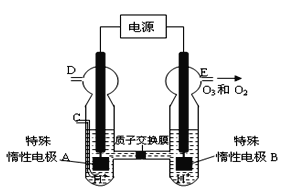
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____.

(2)第一组实验中褪色时间更长的是:_____(填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________。

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______。待到______,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为__________。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______(填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁是人体不可缺少的微量元素,硫玻亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:

(1)实验中用已经准确量取的浓硫酸配制500mL1molL-1的硫酸溶液,则配制时用到的仪器除烧杯、500mL容量瓶外,还需要______、________。
(2)步骤②加入过量氯水后发生反应的离子方程式为______.
(3)步骤④中一系列操作步骤为过滤、洗涤、______、冷却、称量。
(4)某同学发现部分补血剂药片表面发黄,取样品研细,溶于1molL-1的硫酸溶液,过滤.取滤液加______溶液,溶液变红说明该补血剂已部分变质.向变色后的溶液中加入橙汁,溶液红色褪去,说明橙汁含具有______性(填“氧化”或“还原”)的物质.
(5)下列检验(4)中滤液中是否有Fe2+应选用的试剂是______.
A.KSCN溶液B.酸性KMnO4溶液 C.铁粉D.FeCl3溶液.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在里或下能够导电的化合物叫做电解质.电离时,生成的阳离子全部是氢离子(H+)的化合物叫做 .
电离时,生成的阴离子全部是氢氧根离子(OH﹣)的化合物叫做 .
电离时,生成的金属阳离子(或铵根离子NH4+)和酸根离子的化合物叫做 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有CuO,Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有( )
A.4个
B.5个
C.6个
D.7个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com