
����Ŀ��A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ��(�ܼ�)��DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3����E��D����ͬһ���壻Fλ��ds������ԭ�ӵ������ֻ��1�����ӡ�
(1)E+���ӵĵ����Ų�ʽ�� ��
(2)B��C��DԪ�صĵ�һ�������ɴ�С��˳���� ��
(3)B��CԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��Ļ�ѧʽ�� ��B��C����Щ�⻯��ķе����ϴ����Ҫԭ���� ��
(4)A��B��D���γɷ���ʽΪA2BD��ij�������û����������Bԭ�ӵĹ���ӻ������� ��1 mol�÷����к�����������Ŀ�� ��

(5)C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ�� ��Cԭ�ӵ���λ���� ��
���𰸡�(1)1s22s22p63s23p63d10����[Ar] 3d10��
(2)N��O��C
(3)C2H6�������⻯��(N2H4)���Ӽ�������
(4)sp2��1 mol��1NA��
(5)Cu3N��6
�����������������A��B��C��D��E����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A�����ڱ���ԭ�Ӱ뾶��С��Ԫ�أ���AΪHԪ�أ�B�Ļ�̬ԭ���е���ռ��������������ͬ��ԭ�ӹ����ԭ�Ӻ�������Ų�Ϊ1s22s22p2����BΪ̼Ԫ�أ�Dλ�ڵ�2���ڣ���ԭ�Ӻ���ɶԵ�������δ�ɶԵ�������3����ԭ�Ӻ�������Ų�Ϊ1s22s22p4����DΪOԪ�أ�C��ԭ����������̼����֮�䣬��CΪNԪ�أ�E��D����ͬһ���壬��EΪSԪ�أ�Fλ��ds������ԭ�ӵ������ֻ��1�����ӣ���EΪCu��
(1)ͭΪ29��Ԫ�أ�Cu+���ӵĵ����Ų�ʽΪ1s22s22p63s23p63d10���ʴ�Ϊ��1s22s22p63s23p63d10��
(2)ͬ������ԭ����������Ԫ�ص�һ�����ܳ��������ƣ���NԪ��2p�ܼ�Ϊ�����ȶ�״̬�������ϵͣ���һ�����ܸ���ͬ��������Ԫ�أ��ʵ�һ������N��O��C���ʴ�Ϊ��N��O��C��
(3)C��N��Ԫ�ؾ����γɺ�18�������⻯����ӣ����⻯����ӷֱ���X��Y��ʾ����XΪC2H6��YΪN2H4��N2H4����֮����������C2H6����֮������������߷е����ϴʴ�Ϊ��C2H6��N2H4����֮����������C2H6����֮���������
(4)A��B��D���γɷ���ʽΪA2BD��ij������ΪH2CO���ṹ��ʽΪHCHO��������Cԭ�ӵļ۲���Ӷ���=3+![]() ��(4-2��2-2)=3���ӻ�����Ϊsp2��1�������к���1��1������1mol�÷����к�����������ĿΪ1NA���ʴ�Ϊ��1NA��
��(4-2��2-2)=3���ӻ�����Ϊsp2��1�������к���1��1������1mol�÷����к�����������ĿΪ1NA���ʴ�Ϊ��1NA��
(5)ԭ��Ϊ�о��������ڵ�ԭ�Ӵ��������ģ�ÿ������Ϊ8���������ã�������ԭ��Ϊ4���������ã���Cԭ����λ��Ϊ![]() =6���ʴ�Ϊ��Cu3N��6��
=6���ʴ�Ϊ��Cu3N��6��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���л���F��һ�ֹؽ���ֹʹҩ���ϳ�F��һ�ִ�ͳ����·�����£�
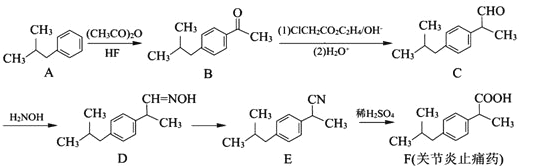
��1��B�к��������ŵ�����Ϊ_________��
��2��C��D�ķ�Ӧ�ɷ�Ϊ�������䷴Ӧ����Ϊ_________��_________��
��3��д����F��5��̼ԭ�ӵ�ͬϵ��X�Ľṹ��ʽ��_______________��дһ�֣���X�ж���ͬ���칹�壬��������������X��ͬ���칹�干��_______________�֡�
�����ڷ����廯����ڱ�����ֻ��1��ȡ�������������������ʣ�
��4��д��Eת��ΪF�����εĻ�ѧ����ʽ��______________________��
��5����֪����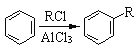
�� 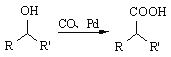 ��R1��R2��ʾ������
��R1��R2��ʾ������
�ϳ�F��һ�ָ���������2������1������[(CH3)2CHCH2OH)]������������[(CH3CO)2O]Ϊԭ�����ϳɣ�д���йصĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�H2C��CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��̼����ĺ���Ӱ�����������ij��ȤС�����������̶Ը�������̽����

(1)��������Ԫ����FeS��ʽ���ڣ�FeS���������������գ����ɵĹ��������Fe��O����Ԫ����������Ϊ21��8����ù������Ļ�ѧʽΪ_____________��
(2)��������������������е�CO2����Ҫ���Լ���____________ (����ĸ����
a.����KMnO4��Һ b.����ʯ��ˮ c.����С�մ���Һ d.ŨH2SO4
(3)ȡ10.00 g���������������г�����գ������ɵ�����������1����H2O2��Һ������գ�����0.1000 mol��L-1NaOH��Һ�ζ�����Һ���յ㣬����NaOH��Һ20.00mL����ȡ10.00g���������������г�����գ������ɵ�����ͨ��ʢ��������ʯ�ҵ�U�ܣ�����ͼ������ʯ������0.614 g��

����l%H2O2��Һ����SO2��������Ӧ�����ӷ���ʽΪ___________________��
���ֱ����ø���������̼Ԫ�ص�����������д��������̣���
��ʵ���õ�̼Ԫ��������������ʵֵƫ���������ܵ�ԭ����______________(����ĸ)
a.U���������ɵ���������������O2
b.��ʯ�������˿����е�CO2
c.����ͨ����ʯ�ҵ����ٹ��죬ĩ���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У����ڵ���ʵ��ǣ� ��
A.�Ȼ�����Һ
B.������̼
C.�������ƹ���
D.��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������岻��ȱ�ٵ���Ԫ�أ����������壨FeSO4��7H2O����ҽҩ������Ѫ����ij����С��ⶨ�ò�Ѫ������Ԫ�صĺ�����������ò�Ѫ���Ƿ���ʡ�ʵ�鲽�����£�

��1��ʵ�������Ѿ�ȷ��ȡ��Ũ��������500mL1molL-1��������Һ��������ʱ�õ����������ձ���500mL����ƿ�⣬����Ҫ______��________��
��2������ڼ��������ˮ������Ӧ�����ӷ���ʽΪ______��
��3���������һϵ�в�������Ϊ���ˡ�ϴ�ӡ�______����ȴ��������
��4��ijͬѧ���ֲ��ֲ�Ѫ��ҩƬ���淢�ƣ�ȡ��Ʒ��ϸ������1molL-1��������Һ�����ˣ�ȡ��Һ��______��Һ����Һ���˵���ò�Ѫ���Ѳ��ֱ��ʣ����ɫ�����Һ�м����֭����Һ��ɫ��ȥ��˵����֭������______�ԣ����������ԭ���������ʣ�
��5�����м��飨4������Һ���Ƿ���Fe2+Ӧѡ�õ��Լ���______��
A��KSCN��ҺB������KMnO4��Һ C������D��FeCl3��Һ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. ��Ȼ������Ҫ�ɷ��Ǽ��� B. CH3Cl��������Һ��
C. ʯ�ͷ����ǻ�ѧ�仯 D. ���ڷ����Բⶨ�л���Ľṹ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֬�����̶Ⱦ�������֬�ij�Ĥ�ԡ�������һ�ֳ�Ĥ�����õĴ�������֬�ĺϳ�·�ߣ�����ͼ��ʾ��

��1���ϳ�A�Ļ�ѧ����ʽ��__________��
��2��B�ķ���ʽΪC4H7Br����B������˳���칹��B�Ľṹ��ʽΪ_______��A��B����ķ�Ӧ������_________��
��3��E�к�����������������______��D ��ϵͳ����Ϊ_________��
��4������˵����ȷ����_______��
A.lmol������C�������3molNaOH
B.lmol������E������������Һ��Ӧ����2molAg
C. F������Cu(OH)2����Һ��Ӧ
D�����顢1-������������D�зе���ߵ��Ƕ���
��5��д��D��F��һ�����������ɴ�������֬�Ļ�ѧ����ʽ__________��
��6�� �ķ�������������ͬ���칹����_____�֡�
�ķ�������������ͬ���칹����_____�֡�
�� ���Ķ�ȡ��������� ��FeCl3��Һ����ɫ���� �ɷ�����ȥ��Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʪ����п������ͭ�������������ӵ��������£�

��֪��ͭ������Ҫ��п��ͭ�������ӣ�Cd�����ܣ�Co���ȵ��ʡ�
�±��г�����ؽ������������������������pH����ʼ������pH����������Ũ��Ϊ0.1 mol��L-1���㣩��
�������� | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
��ʼ������pH | 1.5 | 6.5 | 7.2 | 8.2 |
������ȫ��pH | 3.3 | 9.9 | 9.5 | 10.6 |
��1��Ϊ�����ͭ�������������ʣ��ɲ�ȡ�Ĵ�ʩ�У����ʵ������¶ȣ��ڽ��裻��______�ȡ���֪�����Ľ������Ӿ�Ϊ���ۣ�д�������ܵĻ�ѧ����ʽ__________________��
��2�����ܵĹ����У���Ҫ������Sb2O3��п�ۻ���Sb2O3��Co2+����Һ�γ���ز������Ͻ�CoSb������ص�������ӦʽΪ________________________________��
��3�������Ĺ��̷��������У�
���ȼ�������KMnO4��������Ӧ�����ӷ���ʽΪ______________________________��
���ټ���ZnO���Ʒ�ӦҺ��pH��ΧΪ_____________��
��4���������̵ڢٲ���������KMnO4ʱ�������Ʋ�����MnO2�������Ӧ����ɵĽ����______________���������KMnO4����������������Һ����FeԪ�ز��ࡣ�����ʵ�鷽��������֤_________________��
��5�����������Һ�ö��Ե缫���ɻ���ӵ��ʡ�����Һ�п�ѭ�����õ�������____��
��6���������ӷ�ˮ���û�ѧ�������������Ǽ����ӵ����ܻ�������ܶȻ�������25������
Ksp(CdCO3)��5.210��12�� Ksp(CdS)��3.610��29��Ksp(Cd(OH)2)��2.010��16������������Ϣ��
����Cd2+Ч����ѵ��Լ���____________��
a��Na2CO3 b��Na2S c��CaO
��������ʯ�Ҵ������ӷ�ˮ���pHΪ11����ʱ��Һ��c(Cd2+)��_________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com