
【题目】下列说法正确的是( )
A. 天然气的主要成分是甲烷 B. CH3Cl常温下是液体
C. 石油分馏是化学变化 D. 钠融法可以测定有机物的结构
 华东师大版一课一练系列答案
华东师大版一课一练系列答案科目:高中化学 来源: 题型:
【题目】12mL浓度为0.05mol/L 的Na2SO3溶液恰好与VmL浓度为0.02mol/L的K2X2O7溶液完全反应。已知X元素在产物中的化合价为+3。则V为( )
A. 5 B. 10 C. 15 D. 20
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)下列物质中,只存在离子键的是______,属于共价化合物的是____,不存在化学键的是____。
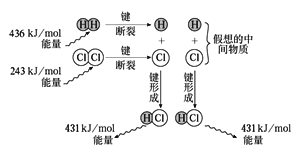
①Ar ②CO2 ③Na2O2 ④H2SO4 ⑤NaCl ⑥NH4Cl ⑦CaO
(2)阴离子Xn﹣含N个中子,X的质量数为A,则ag X的氢化物中含质子的物质的量为_________mol。
(3)观察如图,计算1molH2与1molCl2反应释放的能量为______。若氢气在氯气中燃烧,反应过程中产生苍白色的火焰,该反应中形成2 mol HCl时释放的能量与上述计算的数值相比_______(填“大”或“小”或“相等”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列物质的水溶液中,加入Ba(OH)2溶液后,原溶液中阴、阳离子都减少的是( )
A.CuSO4
B.Ca(NO3)2
C.Na2CO3
D.FeCl3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在使用燃气热水器过程中,因通风不良造成煤气得不到完全燃烧,一氧化碳浓度严重超标,人过量吸入就会引起中毒.下列物质中,与一氧化碳属于同类物质的是( )
A.H2、O3
B.H2SO4、H2CO3
C.SO2、NO
D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,对于反应N2(g)+3H2(g)![]() 2NH3(g) ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是
2NH3(g) ΔH=-92.4 kJ/mol。N2的平衡转化率(α)与体系总压强(p)的关系如图所示。下列说法正确的是

A.将1 mol氮气、3 mol氢气,置于1 L密闭容器中发生反应,放出的热量为92.4 kJ
B.平衡状态由A变到B时,平衡常数KA <KB
C.上述反应在达到平衡后,增大压强,H2的转化率增大
D.升高温度,平衡向逆反应方向移动,说明逆反应速率增大,正反应速率减小
答
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com