
����Ŀ���л���F��һ�ֹؽ���ֹʹҩ���ϳ�F��һ�ִ�ͳ����·�����£�
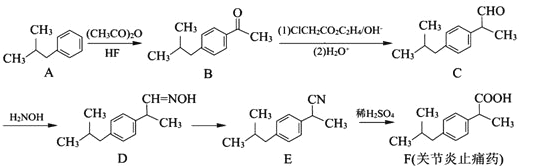
��1��B�к��������ŵ�����Ϊ_________��
��2��C��D�ķ�Ӧ�ɷ�Ϊ�������䷴Ӧ����Ϊ_________��_________��
��3��д����F��5��̼ԭ�ӵ�ͬϵ��X�Ľṹ��ʽ��_______________��дһ�֣���X�ж���ͬ���칹�壬��������������X��ͬ���칹�干��_______________�֡�
�����ڷ����廯����ڱ�����ֻ��1��ȡ�������������������ʣ�
��4��д��Eת��ΪF�����εĻ�ѧ����ʽ��______________________��
��5����֪����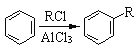
�� 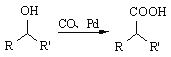 ��R1��R2��ʾ������
��R1��R2��ʾ������
�ϳ�F��һ�ָ���������2������1������[(CH3)2CHCH2OH)]������������[(CH3CO)2O]Ϊԭ�����ϳɣ�д���йصĺϳ�·������ͼ�����Լ���ѡ�����ϳ�·������ͼʾ�����£�H2C��CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
���𰸡� �ʻ� �ӳɷ�Ӧ ��ȥ��Ӧ ![]() ��
��![]() ��
��![]() ��
��![]() 3��
3��![]() ��
��![]() ��
��![]() �� 2
�� 2 ![]() +H2SO4+4H2O��2
+H2SO4+4H2O��2 ![]() +(NH4)2SO4��
+(NH4)2SO4��![]() +H2SO4+2H2O��
+H2SO4+2H2O�� +NH4HSO4
+NH4HSO4 ![]()
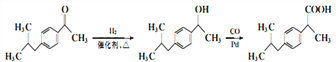
�����������⿼���л���ĺϳɺ��ƶϣ���1������B�Ľṹ��ʽ�����еĹ��������ʻ�����2���Ա�C��D�Ľṹ��ʽ��Ӧ��ȩ����̼��һ�����������ѣ�H2NOH��һ��H��N�����ѣ����ѵ���ԭ�ӣ���ȩ���ϵ���������ʣ�µ����������ṹ��ʽΪ��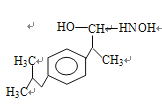 ��Ȼ������ȥ��Ӧ�����C��D�����ӳɷ�Ӧ����ȥ��Ӧ����3����FΪͬϵ����б������Ȼ�����ͬ���칹��Ϊ��
��Ȼ������ȥ��Ӧ�����C��D�����ӳɷ�Ӧ����ȥ��Ӧ����3����FΪͬϵ����б������Ȼ�����ͬ���칹��Ϊ��![]() ��
��![]() ��
��![]() ��
��![]() ��������������
��������������![]() ��
��![]() ��
��![]() ������3�֣���4�������ķ�Ӧ��
������3�֣���4�������ķ�Ӧ��![]() +H2SO4+4H2O��2
+H2SO4+4H2O��2 ![]() +(NH4)2SO4��
+(NH4)2SO4��![]() +H2SO4+2H
+H2SO4+2H +NH4HSO4 ����5������F�Ľṹ��ʽ���Ƴ�2������1��������HCl��һ�������·���ȡ����Ӧ������(CH3)2CHCH2Cl��Ȼ����AlCl3�����£��뱽����ȡ����Ӧ������
+NH4HSO4 ����5������F�Ľṹ��ʽ���Ƴ�2������1��������HCl��һ�������·���ȡ����Ӧ������(CH3)2CHCH2Cl��Ȼ����AlCl3�����£��뱽����ȡ����Ӧ������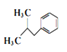 ��
�� ��HF��������������Ӧ���ɣ�
��HF��������������Ӧ���ɣ�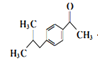 ��
�� �����������ӳɷ�Ӧ������
�����������ӳɷ�Ӧ������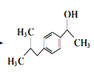 ��Ȼ�������Ϣ������Ŀ�����ϳ�·��Ϊ
��Ȼ�������Ϣ������Ŀ�����ϳ�·��Ϊ![]()
 ��
��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�¶��£��ڹ̶��ݻ����ܱ������У����淴ӦA(g)+3B(g)![]() 2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮��Ϊn(A)��n(B)��n(C)=2��2��1�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C����
2C(g)�ﵽƽ��ʱ�������ʵ����ʵ���֮��Ϊn(A)��n(B)��n(C)=2��2��1�������¶Ȳ��䣬��2��2��1�����ʵ���֮���ٳ���A��B��C����
A��ƽ�ⲻ�ƶ�
B���ٴ�ƽ��ʱ��n(A)��n(B)��n(C)��Ϊ2��2��1
C���ٴ�ƽ��ʱ��C�������������
D���ٴ�ƽ��ʱ������Ӧ���������淴Ӧ���ʼ�С
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��0.5 L 1 mol/L FeCl3��Һ��0.2 L 1 mol/L KCl��Һ�е�Cl-�����ʵ���Ũ��֮�ȣ� ��
A��5��2 B�� 3��1 C��15��2 D�� 1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A.�ᡢ��ζ��ǵ����
B.����ʶ���������ˮ������
C.�����ﶼ�ǵ����
D.�⻯�ﶼ���ǵ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������й����ʵ����ʺͶ�Ӧ��;����������ȷ����
A. SiO2Ӳ�ȴ�����������ά
B. ̼���л�ԭ�ԣ�����̼�ڸ����½��������軹ԭΪ��
C. ͭ�Ľ�����Ա�����������ͭ������������Ũ����
D. �����dz������л��ܼ����������ѻ���������ȡ��ˮ�е���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��12mLŨ��Ϊ0.05mol/L ��Na2SO3��Һǡ����VmLŨ��Ϊ0.02mol/L��K2X2O7��Һ��ȫ��Ӧ����֪XԪ���ڲ����еĻ��ϼ�Ϊ+3����VΪ�� ��
A. 5 B. 10 C. 15 D. 20
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ�������������е���ĸ�ֱ����ijһ��ѧԪ�أ��û�ѧ���Żش��������⡣

��1��Ԫ��J�����ڱ��е�λ����____________��
��2��Ԫ��G��Ԫ��I��Ӧ������������ˮ����֮���ܷ�����ѧ��Ӧ����д���÷�Ӧ�����ӷ���ʽ____________��
��3����A��J�У�ԭ�Ӱ뾶������_______������õķǽ�����_______������������ˮ������������ǿ����_______��
��4����G��H�л�ѧ���ʱȽϻ��õ���_______������ƻ�ѧʵ�����֤��_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ������ȡ������װ�ú�ѡ�õ��Լ������д�����ǣ� ��
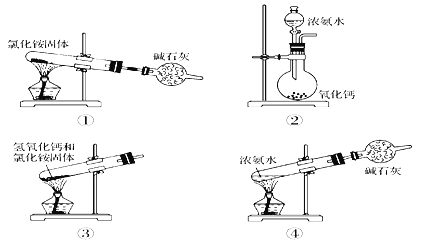
A. �٢� B. �ڢ� C. �ۢ� D. �٢�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A��B��C��D��E��F����Ԫ�ؾ�λ�����ڱ���ǰ�����ڣ���ԭ��������������Ԫ��A��ԭ�Ӱ뾶��С��Ԫ�أ�BԪ�ػ�̬ԭ�ӵĺ�����ӷ�ռ�ĸ�ԭ�ӹ��(�ܼ�)��DԪ��ԭ�ӵ��ѳɶԵ���������δ�ɶԵ���������3����E��D����ͬһ���壻Fλ��ds������ԭ�ӵ������ֻ��1�����ӡ�
(1)E+���ӵĵ����Ų�ʽ�� ��
(2)B��C��DԪ�صĵ�һ�������ɴ�С��˳���� ��
(3)B��CԪ�ص�ijЩ�⻯��ķ����о�����18�����ӣ���B�������⻯��Ļ�ѧʽ�� ��B��C����Щ�⻯��ķе����ϴ����Ҫԭ���� ��
(4)A��B��D���γɷ���ʽΪA2BD��ij�������û����������Bԭ�ӵĹ���ӻ������� ��1 mol�÷����к�����������Ŀ�� ��

(5)C��F��Ԫ���γɵ�ij������ľ����ṹ��ͼ��ʾ����û�����Ļ�ѧʽ�� ��Cԭ�ӵ���λ���� ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com