
【题目】0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比( )
A.5:2 B. 3:1 C.15:2 D. 1:3
科目:高中化学 来源: 题型:
【题目】甲醛(HCHO)与葡萄糖相似具有强还原性,40%甲醛溶液沸点为96℃,易挥发。为探究过量甲醛和新制Cu(OH)2反应的产物,进行如下研究。
(1)在下图装置中进行实验,向a中加入0.5 mol·L-1CuSO4溶液50mL和5 mol·L-1NaOH溶液100mL,振荡,再加入40%的甲醛溶液50mL,缓慢加热a,在65℃时回流20分钟后冷却至室温。反应过程中观察到有棕色固体生成,最后变成红色,并有气体产生。
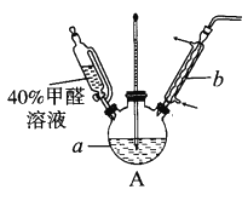
①仪器b的名称是___________,作用为__________。
②能说明甲醛具有还原性的实验现象是___________。
(2)查阅资料发现气体产物是副反应产生的。为确认气体产物中含H2不含CO,将装置A和如下图所示的装置连接后进行实验。
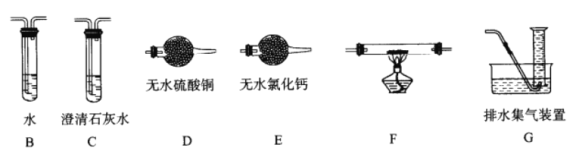
依次连接的合理顺序为A→B→___→___→___→___G,装置B的作用是_________。
(3)已知:![]() 。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
。设计实验证明a中甲醛的碳元素未被氧化成+4价。_________________。
(4)为研究红色固体产物的组成,进行如下实验(以下每步均充分反应);
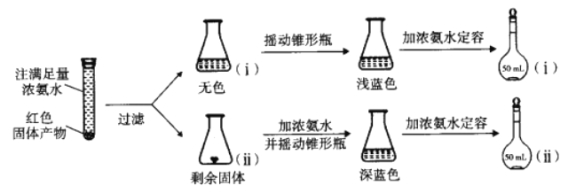
已知:Cu2O![]() [Cu(NH3)4]+(无色)
[Cu(NH3)4]+(无色)![]() [Cu(NH3)4]2+](蓝色)。
[Cu(NH3)4]2+](蓝色)。
①摇动锥形瓶ⅰ的目的是_____________。
②锥形瓶ⅱ中固体完全溶解得深蓝色溶液的离子方程式为______________。
③将容量瓶ⅱ中的溶液稀释100倍后,溶液的颜色与容量瓶ⅰ相近。由此可知固体产物的组成及物质的量之比约为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.有浓度均为0.1mol/L的盐酸、硫酸、醋酸三种溶液:
(1)若三种溶液氢离子浓度依次为a1、a2、a3 mol/L,则它们的大小关系为___________________。
(2)等体积的以上三种酸分别与过量的NaOH溶液反应,若生成盐的物质的量依次为b1、b2、b3mol,则它们的大小关系是___________________。
(3)分别用以上三种酸中和一定量的NaOH溶液生成正盐,若需酸溶液的体积依次为V1、V2、V3L,则其大小关系是_________________。
(4)分别与锌反应,开始是产生H2的速率为ν1、ν2、ν3, 则其大小关系是_________________。
(5)若三种溶液由水电离出的H+浓度依次为c1、c2、c3mol/L,则它们的大小关系是_____________。
II.相同条件下的pH=3的盐酸和pH=3的醋酸:
(1)取等体积两溶液,分别稀释pH=4时,两者加水量的关系是:前者________后者(填>、<或=,下同)
(2)取等体积的两溶液,分别加入等物质的量的相应钠盐固体少量,两溶液的pH大小关系是:前者_________后者;
(3)各取两溶液VL,分别加入VLpH=11的NaOH,充分反应后,两溶液pH大小关系是:前者______ ____后者。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O)。下列说法正确的是( )
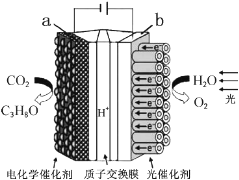
A. 该装置将化学能转化为光能和电能
B. 该装置工作时,H+从b极区向a极区迁移
C. 每生成1molO2,有44g CO2被还原
D. a电极的反应为:3CO2+18H+-18e-=C3H8O+5H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于常温下pH=2的醋酸溶液,下列叙述正确的是
A.c(H+)=c(CH3COO-)
B.加水稀释时![]() 增大
增大
C.与pH = 12的NaOH溶液等体积混合后,溶液呈中性
D.加入醋酸钠固体可抑制醋酸的电离,电离常数Ka变小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. 铅蓄电池充电时,阳极质量增大
B. 0.1mol ·L-lCH3COONa溶液加热后,溶液的pH减小
C. 标准状况下,11.2L苯中含有的碳原子数为3×6.02×1023
D. 室温下,稀释0.1mol·L-1氨水,c(H+)·c(NH3·H2O)的值减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物F是一种关节炎止痛药,合成F的一种传统法的路线如下:
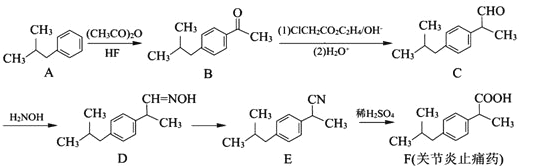
(1)B中含氧官能团的名称为_________。
(2)C→D的反应可分为两步,其反应类型为_________、_________。
(3)写出比F少5个碳原子的同系物X的结构简式:_______________(写一种);X有多种同分异构体,满足下列条件的X的同分异构体共有_______________种。
①属于芳香族化合物;②苯环上只有1个取代基;③属于酯类物质;
(4)写出E转化为F和无机盐的化学方程式:______________________。
(5)已知:①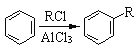
② 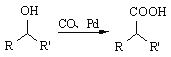 (R1、R2表示烃基)
(R1、R2表示烃基)
合成F的一种改良法是以2—甲基—1—丙醇[(CH3)2CHCH2OH)]、苯、乙酸酐[(CH3CO)2O]为原料来合成,写出有关的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:H2C=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH__________________
CH3CH2OH__________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。

(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。

①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com