
【题目】碳、硫的含量影响钢铁性能。某兴趣小组用如下流程对钢样进行探究。

(1)钢样中硫元素以FeS形式存在,FeS在足量氧气中灼烧,生成的固体产物中Fe、O两种元素的质量比为21:8,则该固体产物的化学式为_____________。
(2)检验钢样灼烧生成气体中的CO2,需要的试剂是____________ (填字母)。
a.酸性KMnO4溶液 b.澄清石灰水 c.饱和小苏打溶液 d.浓H2SO4
(3)取10.00 g钢样在足量氧气中充分灼烧,将生成的气体用足量1%的H2O2溶液充分吸收,再用0.1000 mol·L-1NaOH溶液滴定吸收液至终点,消耗NaOH溶液20.00mL;另取10.00g钢样在足量氧气中充分灼烧,将生成的气体通过盛有足量碱石灰的U型管(如下图),碱石灰增重0.614 g。

①用l%H2O2溶液吸收SO2,发生反应的离子方程式为___________________。
②分别计算该钢样中硫、碳元素的质量分数(写出计算过程)。
③实验测得的碳元素质量分数比真实值偏高,其可能的原因是______________(填字母)
a.U型管中生成的亚硫酸盐吸收了O2
b.碱石灰吸收了空气中的CO2
c.气体通过碱石灰的流速过快,末被充分吸收
【答案】 Fe3O4 ab H2O2+SO2═2H++SO42- n(S)= n(SO2)= ![]() n(NaOH)
n(NaOH)
=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol
w(S)= ![]() ×100%=0.32%
×100%=0.32%
m(CO2)=0.614- m(SO2)=0.550g
n(C)= n(CO2) =![]() =0.0125mol
=0.0125mol
w(C)= ![]() ×100%=1.5%
×100%=1.5%
ab
【解析】(1) 生成的固体产物中Fe、O两种元素的质量比为21:8,则Fe、O两种元素的物质的量之比为![]() :
: ![]() =
=![]() ,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
,则该固体产物的化学式为Fe3O4,故答案为:Fe3O4;
(2)钢样灼烧生成气体中含有CO2和SO2,二氧化硫也能够使澄清石灰水变浑浊,因此需要用酸性KMnO4溶液反应除去二氧化硫后再用澄清石灰水检验,故答案为:ab;
(3)①用l%H2O2溶液吸收SO2,将二氧化硫氧化生成硫酸,反应的离子方程式为H2O2+SO2═2H++SO42-,故答案为:H2O2+SO2═2H++SO42-;
②n(S)= n(SO2)= ![]() n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)=
n(NaOH)=1/2×0.02000L×0.1000mol·L-1=1.000×10-3mol ,w(S)= ![]() ×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =
×100%=0.32% ,m(CO2)=0.614- m(SO2)=0.550g ,n(C)= n(CO2) =![]() =0.0125mol ,w(C)=
=0.0125mol ,w(C)= ![]() ×100%=1.5% ,故答案为:1.5%;
×100%=1.5% ,故答案为:1.5%;
③a.U型管中生成的亚硫酸盐吸收了O2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;b.碱石灰吸收了空气中的CO2,导致碱石灰增重偏大,测得的二氧化碳偏大,碳元素质量分数比真实值偏高,正确;c.气体通过碱石灰的流速过快,末被充分吸收,导致碱石灰增重偏小,测得的二氧化碳偏小,碳元素质量分数比真实值偏低,错误;故选ab。


科目:高中化学 来源: 题型:
【题目】0.5 L 1 mol/L FeCl3溶液与0.2 L 1 mol/L KCl溶液中的Cl-的物质的量浓度之比( )
A.5:2 B. 3:1 C.15:2 D. 1:3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素,用化学符号回答下列问题。

(1)元素J在周期表中的位置是____________。
(2)元素G和元素I对应的最高价氧化物的水化物之间能发生化学反应,试写出该反应的离子方程式____________。
(3)在A~J中,原子半径最大的是_______,最活泼的非金属是_______,最高价氧化物的水化物中酸性最强的是_______。
(4)在G和H中化学性质比较活泼的是_______,请设计化学实验加以证明_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 在食品袋中放入CaCl2·6H2O,可防止食物受潮
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. SO3溶于水形成的溶液能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图所示与对应叙述相符的是

A. 图甲表示一定温度下FeS和CuS的沉淀溶解平衡曲线,则Ksp(FeS)>Ksp(CuS)
B. 图乙表示pH=2的甲酸与乙酸溶液稀释时的pH变化曲线,则酸性:甲酸<乙酸
C. 图丙表示用0.1000 mol·L-lNaOH溶液滴定25.00 mL盐酸的滴定曲线,则 c(HCl)=0.0800 mol ·L-1
D. 图丁表示反应N2(g)+3H2(g) ![]() 2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
2NH3(g)平衡时NH3体积分数随起始n(N2)/n(H2)变化的曲线,则转化率:αA(H2)=αB(H2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
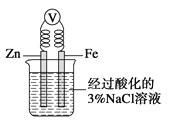
A. 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B. 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色
C. 如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成
D. 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 反应进行到1 s时,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com