
【题目】利用湿法炼锌产生的铜镉渣生产金属镉的流程如下:

已知:铜镉渣主要含锌、铜、铁、镉(Cd)、钴(Co)等单质。
下表列出了相关金属离子生成氢氧化物沉淀的pH(开始沉淀的pH按金属离子浓度为0.1 mol·L-1计算):
氢氧化物 | Fe(OH)3 | Fe(OH)2 | Cd(OH)2 | Mn(OH)2 |
开始沉淀的pH | 1.5 | 6.5 | 7.2 | 8.2 |
沉淀完全的pH | 3.3 | 9.9 | 9.5 | 10.6 |
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③______等。已知浸出的金属离子均为二价,写出浸出钴的化学方程式__________________。
(2)除钴的过程中,需要加入活化剂Sb2O3,锌粉会与Sb2O3、Co2+的溶液形成微电池并产生合金CoSb。该微电池的正极反应式为________________________________。
(3)除铁的过程分两步进行:
①先加入适量KMnO4,发生反应的离子方程式为______________________________,
②再加入ZnO控制反应液的pH范围为_____________。
(4)除铁过程第①步,若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是______________,若加入的KMnO4不足量,则待电解溶液中有Fe元素残余。请设计实验方案加以验证_________________。
(5)净化后的溶液用惰性电极电解可获得镉单质。电解废液中可循环利用的溶质是____。
(6)处理含镉废水常用化学沉淀法,以下是几种镉的难溶化合物的溶度积常数(25℃):
Ksp(CdCO3)=5.210-12, Ksp(CdS)=3.610-29,Ksp(Cd(OH)2)=2.010-16,根据上述信息:
沉淀Cd2+效果最佳的试剂是____________。
a.Na2CO3 b.Na2S c.CaO
若采用生石灰处理含镉废水最佳pH为11,此时溶液中c(Cd2+)=_________。
【答案】 增大硫酸的浓度(或经铜镉渣研成粉末) Co+H2SO4=== CoSO4+H2↑ Sb2O3+2Co2++6H++10e-===2CoSb+3H2O 3Fe2++MnO+4H+===3Fe3++MnO2+2H2O 3.3~7.2 还原产物Mn2+,进入电解液中,引入杂质 取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红(或向其中滴加K3[Fe(CN)6]溶液,若产生蓝色沉淀),则待电解液中含有Fe元素 H2SO4(或硫酸) b 2.010-10mol/L
【解析】本题分析:本题主要考查溶液中的离子反应。
(1)为了提高铜镉渣浸出的速率,可采取的措施有:①适当升高温度;②搅拌;③增大硫酸的浓度(或将铜镉渣研成粉末)等。浸出钴的化学方程式为Co+H2SO4=CoSO4+H2↑。
(2)该微电池的正极反应式为Sb2O3+2Co2++6H++10e-=2CoSb+3H2O。
(3)除铁的过程分两步进行,①加入适量KMnO4,将Fe2+氧化为Fe3+ ,发生反应的离子方程式为3Fe2++MnO4-+4H+=3Fe3++MnO2+2H2O,②加入ZnO提高pH,将Fe3+转化为Fe(OH)3过滤除去,同时不能损失Cd2+,所以控制反应液的pH范围为3.3-7.2。
(4)若加入KMnO4时条件控制不当,MnO2会继续反应,造成的结果是还原产物Mn2+进入电解液中,引入杂质,若加入的KMnO4不足量,则待电解溶液中有Fe元残余。验证方法:取样,向其中滴加H2O2后再滴入KSCN溶液,若溶液变红,则待电解液中含有Fe元素。
(5)阳极产生硫酸,所以电解废液中可循环利用的溶质是硫酸。
(6)因为Ksp(CdS)最小,所以沉淀Cd2+效果最佳的试剂是b。
c(OH-)=![]() =
=![]() mol/L=1×10-3mol/L,c(Cd2+)=
mol/L=1×10-3mol/L,c(Cd2+)=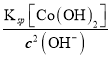 =2.0×10-10mol/L。
=2.0×10-10mol/L。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F六种元素均位于周期表的前四周期,且原子序数依次增大。元素A是原子半径最小的元素;B元素基态原子的核外电子分占四个原子轨道(能级);D元素原子的已成对电子总数是未成对电子总数的3倍;E与D处于同一主族;F位于ds区,且原子的最外层只有1个电子。
(1)E+离子的电子排布式是 。
(2)B、C、D元素的第一电离能由大到小的顺序是 。
(3)B、C元素的某些氢化物的分子中均含有18个电子,则B的这种氢化物的化学式是 ;B、C的这些氢化物的沸点相差较大的主要原因是 。
(4)A、B、D可形成分子式为A2BD的某化合物,则该化合物分子中B原子的轨道杂化类型是 ;1 mol该分子中含有π键的数目是 。

(5)C、F两元素形成的某化合物的晶胞结构如图所示,则该化合物的化学式是 ,C原子的配位数是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】反应4A(s)+3B(g)===2C(g)+D(g),经2 min,B的浓度减少0.6 mol·L-1。下列说法正确的是( )
A.用A表示的反应速率是0.4 mol·L-1·min-1
B.分别用B、C、D表示反应的速率,其比值是3∶2∶1
C.在2 min末的反应速率,用B表示是0.3 mol·L-1·min-1
D.在这2 min内B和C两物质浓度都是逐渐减小的
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在使用燃气热水器过程中,因通风不良造成煤气得不到完全燃烧,一氧化碳浓度严重超标,人过量吸入就会引起中毒.下列物质中,与一氧化碳属于同类物质的是( )
A.H2、O3
B.H2SO4、H2CO3
C.SO2、NO
D.Na2SO3、KClO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,向容积为2 L的密闭容器中通入两种气体发生化学反应,反应中各物质的物质的量变化如图所示,对该反应的推断合理的是

A. 该反应的化学方程式为6A+2 D![]() 3B+4C
3B+4C
B. 反应进行到1 s时,v(A)=v(B)
C. 反应进行到5 s时,B的平均反应速率为0.06mol/(L·s)
D. 反应进行到5 s时,v(A)=v(B)=v(C)=v(D)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】通过以下途径可以合成具有导电性的高分子材料F:

已知:

(1)物质C所含官能团的名称为____________,试剂X的结构简式是___________。
(2)条件Y是________________
(3)请写出反应②的化学方程式:__________________
(4)C与H2以1:2反应所得产物的系统命名是________________
(5)反应⑥的化学反应类型为________,反应⑤的化学方程式_____________。
(6)反应①常用饱和食盐水代替H2O,其目的是_________________
(7)写出符合下列条件在B的所有同分异构体_______________。
①能与银氨溶液反应 ②核磁共振氢谱有3个吸收峰
(8)参照上述合成信息,以丙炔、甲醛和乙酸为原料(无机试剂任选)设计路线合成乙酸—2-炔-1-丁酯
 _________________。
_________________。
合成路线示例如下:CH2=CH2![]() CH3CH2Br
CH3CH2Br![]() CH3CH2OH
CH3CH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法精炼含有Fe、Zn、Ag等杂质的粗铜。下列叙述正确的是
A.电解时以硫酸铜溶液作电解液,精铜作阳极
B.粗铜与电源负极相连,发生氧化反应
C.阴极上发生的反应是Cu2++2e-=Cu
D.电解后Fe、Zn、Ag等杂质会沉积在电解槽底部形成阳极泥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com