
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
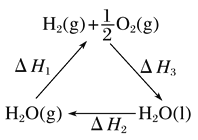
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
 举一反三单元同步过关卷系列答案
举一反三单元同步过关卷系列答案科目:高中化学 来源: 题型:
【题目】有关物质的转化关系如下图所示(部分物质与条件己略去)。A是常见的金属单质, B是常见的强酸,D是常见的气体单质,E是空气中含量最多的气体,I是既能与强酸又能与强碱反应的氧化物,G是最常见的无色液体,J是一种高硬度材料(摩尔质量为41g/ mol)。

请回答下列问题:
(1)D的化学式为___________。
(2)F的电子式为___________。
(3)G的结构式为___________。
(4)写出反应①的离子方程式:___________。
(5)写出反应②的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2 转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是
A. 该过程中CeO2为H2O、CO2 转变为H2、CO的催化剂
B. 该过程实现了太阳能向化学能的转化
C. 1mol CeO2参加反应,共生成2xmol的气体
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO32-+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)利用反应Cu+2FeCl3=CuCl2+2FeCl2设计成如图所示原电池,回答下列问题:

①写出电极反应式:正极___________________;负极_________________。
②图中X溶液是________,Y溶液是________。
③原电池工作时,盐桥中的________(填“阳”或“阴”)离子向X溶液方向移动。

(2)控制适合的条件,将反应2Fe3++2I-![]() 2Fe2++I2,设计成如图所示的原电池。
2Fe2++I2,设计成如图所示的原电池。
请回答下列问题:
反应开始时,乙中石墨电极上发生____________(填“氧化”或“还原”)反应,电极反应式为________________。甲中石墨电极上发生______________反应,电极反应式为___________。
②电流计读数为0时,反应达到平衡状态,此时在甲中加入FeCl2固体,则乙中的石墨作___________(填“正”或“负”)极,该电极的电极反应式为____________________。
(3)利用反应2Cu+O2+2H2SO4=2CuSO4+2H2O可制备CuSO4,若将该反应设计为原电池,其正极电极反应式为_____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I. NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。
已知:反应①:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应②:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
写出NO分解生成N2与O2的热化学方程式:______________________________。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应①,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述正确的是___________(填选项字母)。
A.使用催化剂,可加快反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均反应速率v(NO)=0.088mol·L-1·min-1
II.实验室通常用MnO2作催化剂分解H2O2,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组的同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:__________________________________________________。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3溶液在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
span> | 促进H2O2分解的微粒 |
甲同学 | H2O |
乙同学 | Fe3+ |
丙同学 | Cl- |
你认为最不可能的是_______同学的猜想,理由是____________________________。
(3)同学们对余下的两个猜想用实验进行了探究,请你仔细分析后完成表格:
实验过程 | 实验现象 | 结论 |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | _______________ |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | _______________ | _______________ |
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
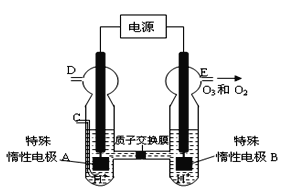
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】完成下列有关KMnO4溶液和H2C2O4溶液的实验:
【实验一】用0.01mol/L 酸性KmnO4溶液和0.2mol/L H2C2O4溶液分别进行了如图所示的三组实验,用于探究不同条件对化学反应速率的影响。回答下列问题:
(1)KMnO4溶液需用_____进行酸化,参加反应的物质n(KMnO4):n(H2C2O4)=_____.

(2)第一组实验中褪色时间更长的是:_____(填“A”或“B”)组实验。
(3)第二组实验中B组实验中X为:__________。

(4)第三组实验发现Mn2+能加快该反应的速率,催化剂Y的化学式为_________。
【实验二】测定某乙二酸晶体(H2C2O4·xH2O)中的x值,具体操作如下:
(5)滴定:称取2.52g 乙二酸晶体,配成100mL溶液,准确量取25.00mL乙二酸溶液于锥形瓶中,加少量酸酸化,将0.1mol/L KMnO4标准溶液装入_____(填“酸式”或“碱式”)滴定管,进行滴定操作。在实验中发现,刚滴下少量KMnO4溶液时,需将锥形瓶摇动一段时间后,紫红色才慢慢褪去,再继续滴加时,紫红色就很快褪去了。出现上述现象的原因是_______。待到______,证明达到滴定终点。
(6)计算:再重复上述操作3次,记录数据如下表:
实验次数 | 滴定前读数(mL) | 滴定后读数(mL) |
1 | 0.00 | 20.10 |
2 | 1.00 | 20.90 |
3 | 0.20 | 20.20 |
4 | 0.00 | 22.10 |
则x为__________。
(7)误差分析:下列操作会导致测量的乙二酸溶液浓度偏高的是_______(填序号)
A.配制KMnO4标准溶液定容时,仰视观察刻度线
B.不小心将少量酸性KMnO4标准溶液滴到锥形瓶外
C.滴定前锥形瓶中有少量蒸馏水
D.滴定前滴定管尖嘴部分有气泡,滴定后气泡消失
E.观察读数时,滴定前仰视读数,滴定后俯视读数
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有CuO,Fe、H2、Ba(OH)2溶液、K2CO3溶液、NaOH溶液、稀硫酸七种物质,在常温下两种物质两两间能发生反应最多有( )
A.4个
B.5个
C.6个
D.7个
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com