
【题目】I. NH3作为一种重要化工原料,被大量应用于工业生产,与其有关性质反应的催化剂研究曾被列入国家863计划。
(1)催化剂常具有较强的选择性,即专一性。
已知:反应①:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1
反应②:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1
写出NO分解生成N2与O2的热化学方程式:______________________________。
(2)在恒温恒容装置中充入一定量的NH3和O2,在某催化剂的作用下进行反应①,测得不同时间的NH3和O2的浓度如下表:
时间(min) | 0 | 5 | 10 | 15 | 20 | 25 |
C(NH3)/mol·L-1 | 1.00 | 0.36 | 0.12 | 0.08 | 0.072 | 0.072 |
C(O2)/mol·L-1 | 2.00 | 1.20 | 0.90 | 0.85 | 0.84 | 0.84 |
则下列有关叙述正确的是___________(填选项字母)。
A.使用催化剂,可加快反应速率
B.若测得容器内4v正(NH3)=6v逆(H2O)时,说明反应已达平衡
C.当容器内![]() =1时,说明反应已达平衡
=1时,说明反应已达平衡
D.前10分钟内的平均反应速率v(NO)=0.088mol·L-1·min-1
II.实验室通常用MnO2作催化剂分解H2O2,已知CuSO4溶液对过氧化氢的分解也具有催化作用,某实验兴趣小组的同学猜想其他盐溶液也可能在这个反应中起同样的作用,于是他们做了以下探究。请你帮助他们完成实验报告:
(1)实验过程:在一支试管中加入5 mL 5%的H2O2溶液,然后滴入适量的FeCl3溶液,把带火星的木条伸入试管。
实验现象:__________________________________________________。
实验结论:FeCl3溶液可以催化分解H2O2。
(2)已知FeCl3溶液在水中可解离出Fe3+和Cl-,同学们提出以下猜想:
span> | 促进H2O2分解的微粒 |
甲同学 | H2O |
乙同学 | Fe3+ |
丙同学 | Cl- |
你认为最不可能的是_______同学的猜想,理由是____________________________。
(3)同学们对余下的两个猜想用实验进行了探究,请你仔细分析后完成表格:
实验过程 | 实验现象 | 结论 |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的 HCl,把带火星的木条伸入试管. | 无明显现象 | _______________ |
向盛有5 mL 5%的H2O2溶液的试管中滴入少量的Fe2(SO4)3,把带火星的木条伸入试管. | _______________ | _______________ |
【答案】 2NO(g)=N2(g)+O2(g) △H=-180.8KJ·mol-1 AD 试管中有大量气泡产生,带火星的木条复燃 甲 过氧化氢溶液中自身有水,可见水不是催化剂 起催化作用的不是Cl- 试管中有大量气泡产生,带火星的木条复燃 起催化作用的是Fe3+
【解析】I. (1)已知:①:4NH3(g) +5O2(g)![]() 4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1,②:4NH3(g)+3O2(g)
4NO(g) +6H2O(g) △H=-905.0 kJ·molˉ1,②:4NH3(g)+3O2(g)![]() 2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1,根据盖斯定律(②-①)/2即得到NO分解生成N2与O2的热化学方程式为2NO(g)=N2(g)+O2(g) △H=-180.8kJ·mol-1。(2)A.使用催化剂,可加快反应速率,A正确;B.4v正(NH3)=6v逆(H2O)不满足反应速率之比是相应的化学计量数之比,反应没有达平衡,B错误;C.当容器内
2N2(g) +6H2O(g) △H=-1266.6 kJ·molˉ1,根据盖斯定律(②-①)/2即得到NO分解生成N2与O2的热化学方程式为2NO(g)=N2(g)+O2(g) △H=-180.8kJ·mol-1。(2)A.使用催化剂,可加快反应速率,A正确;B.4v正(NH3)=6v逆(H2O)不满足反应速率之比是相应的化学计量数之比,反应没有达平衡,B错误;C.当容器内![]() =1时不能说明正逆反应速率相等,反应不一定已达平衡,C错误;D.前10分钟内消耗氨气是0.88mol/L,则生成NO是0.88mol/L,所以平均反应速率v(NO)=0.88mol/L÷10min=0.088mol·L-1·min-1,D正确,答案选AD。II.(1)根据实验结论可得知FeCl3溶液能催化H2O2分解,因此,向5%的过氧化氢溶液加入FeCl3溶液时,可以观察到:试管中有大量的气泡产生,伸入的带火星的木条复燃;(2)由于过氧化氢溶液中自身有水,可见水不是催化剂;(3)为检验Cl-向过氧化氢溶液中加入了含有Cl-的稀盐酸,观察到无明显改变,说明溶液中的Cl-不能对过氧化氢分解起到催化作用;因此,可推测溶液中的Fe3+催化了过氧化氢的分解,因此另一个探究实验应加入含有Fe3+的溶液进行,并应观察到产生大量气体和带火星木条的复燃;故可加入含Fe3+的硫酸铁溶液或硝酸铁溶液。
=1时不能说明正逆反应速率相等,反应不一定已达平衡,C错误;D.前10分钟内消耗氨气是0.88mol/L,则生成NO是0.88mol/L,所以平均反应速率v(NO)=0.88mol/L÷10min=0.088mol·L-1·min-1,D正确,答案选AD。II.(1)根据实验结论可得知FeCl3溶液能催化H2O2分解,因此,向5%的过氧化氢溶液加入FeCl3溶液时,可以观察到:试管中有大量的气泡产生,伸入的带火星的木条复燃;(2)由于过氧化氢溶液中自身有水,可见水不是催化剂;(3)为检验Cl-向过氧化氢溶液中加入了含有Cl-的稀盐酸,观察到无明显改变,说明溶液中的Cl-不能对过氧化氢分解起到催化作用;因此,可推测溶液中的Fe3+催化了过氧化氢的分解,因此另一个探究实验应加入含有Fe3+的溶液进行,并应观察到产生大量气体和带火星木条的复燃;故可加入含Fe3+的硫酸铁溶液或硝酸铁溶液。


 孟建平小学滚动测试系列答案
孟建平小学滚动测试系列答案科目:高中化学 来源: 题型:
【题目】—定温度下,下列溶液的离子浓度关系式正确的是( )
A. pH=5 的H2S溶液中,c(H+)>c(HS-)=1×10-5mol/L
B. 将等物质的量的Na2CO3和NaHCO3混合溶于水中:![]()
C. pH之和为14的H2C2O4与NaOH 溶液混合:c(Na+)>c(H+)>c(OH-)>c(HC2O4-)
D. 0.1 mol / L 的硫酸铵溶液中:c(SO42-)>c(NH4+)> c(H+)> c(OH-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关物质的性质和对应用途的描述均正确的是
A. SiO2硬度大,可用于制造光导纤维
B. 碳具有还原性,可用碳在高温下将二氧化硅还原为硅
C. 铜的金属活动性比铝弱,可用铜罐代替铝罐贮运浓硝酸
D. 汽油是常见的有机溶剂,可以用裂化汽油来萃取溴水中的溴
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,表中所列的字母分别代表某一化学元素,用化学符号回答下列问题。

(1)元素J在周期表中的位置是____________。
(2)元素G和元素I对应的最高价氧化物的水化物之间能发生化学反应,试写出该反应的离子方程式____________。
(3)在A~J中,原子半径最大的是_______,最活泼的非金属是_______,最高价氧化物的水化物中酸性最强的是_______。
(4)在G和H中化学性质比较活泼的是_______,请设计化学实验加以证明_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
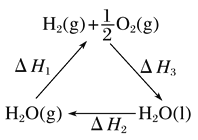
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列表述正确的是
A. 在食品袋中放入CaCl2·6H2O,可防止食物受潮
B. 硅是制造太阳能电池的常用材料
C. 四氧化三铁俗称铁红,可用作油漆、红色涂料
D. SO3溶于水形成的溶液能导电,所以SO3是电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
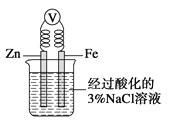
A. 将一小块铜片放入盛有浓硫酸的试管中加热反应后的溶液呈蓝色
B. 将一小块钠放入盛有水的烧杯中,钠在水面上游动,同时看到烧杯内的溶液变为红色
C. 如图,一段时间后给烧杯内的溶液中加入氢氧化钠溶液,可看到Fe电极附近有红褐色沉淀生成
D. 向盛有少量Mg(OH)2沉淀悬浊液的试管中滴加氯化铵溶液,可看到沉淀溶解
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com