
【题目】下列比较不正确的是
A. 酸性:H2SO4>H3PO4 B. 碱性:KOH>NaOH
C. 原子半径:S<Cl D. 稳定性:NH3>CH4
科目:高中化学 来源: 题型:
【题目】现有A、B、C、D、E、F原子序数依次增大的六种元素,它们位于元素周期表的前四周期。B元素含有3个能级,且毎个能级所含的电子数相间;D的原子核外有8个运动状态不同的电子;E元素与F元素处于同一周期相邻的族,它们的原子序数相差3,且E元素的基态原子有4个未成对电子。请回答下列问题:
(1)请写出:D基态原子的价层电子排布图__________;F基态原子的外围电子排布式:_________。
(2)下列说法错误的是_________。
A.二氧化硅的相对分子质量比二氧化碳大,所以沸点:SiO2>CO2
B.电负性顺序:B<C<D
C.N2与CO为等电子体,结构相似。
D.稳定性:H2O>H2S,水分子更稳定的原因是水分子间存在氢键
(3)F离子是人体内多种酶的辅因子,人工模拟酶是当前研究的热点。向F硫酸盐溶液中通入过量的C与A形成的气体X可生成[F (X)4]2+,该离子的结构式为______(用元素符号表示)。
(4)某化合物与F(I)(I表示化合价为+1)结合形成图1所示的离子,该离子中碳原子的杂化方式有________。
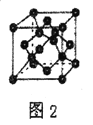
(5)B单质的一种同素异形体的晶胞如图2所示,则一个晶胞中所含B原子数为_______。
(6)D与F形成离子个数比为1:1的化合物,晶胞与NaCl类似,设D离子的半径为a pm, F离子的半径b pm,求该晶胞的空间利用率________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在常温下,pH=9的NaOH溶液和CH3COONa两种溶液中,假设由水电离产生的OH- 离子浓度分别为a和b,则a与b的关系为( )
A. a>b B. a=10﹣4b C. b=10﹣4a D. a=b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】非索非那定(E)可用于减轻季节性过敏鼻炎引起的症状。其合成路线如下
(其中R-为 )
)

(1) E中的含氧官能团名称为___________和___________。
(2) X的分子式为C14Hl5ON,则X的结构简式为___________。
(3) B→C的反应类型为____________________。
(4) 一定条件下,A可转化为F( )。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
)。写出同时满足下列条件的F的一种同分异构体的结构简式:_________。
①能与FeCl3溶液发生显色反应;②能使溴水褪色;③有3种不同化学环境的氢
(5)已知:![]() 。化合物G(
。化合物G( )是制备非索非那定的一种中间体。请以
)是制备非索非那定的一种中间体。请以![]() 为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
为原料制备G,写出相应的合成路线流程图(无机试剂任用,合成路线流程图示例见本题题干)_______
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸的消费量是衡量一个国家化工生产水平的重要标志。在硫酸的生产中,最关键的一步反应为2SO2(g)+O2(g)![]() 2SO3(g)
2SO3(g)
(1)一定条件下,SO2与O2反应10min后,若SO2和SO3的物质的量浓度分别为1mol/L和3mol/L,则SO2起始物质的量浓度为____________________;10min内生成SO3的平均反应速率v(SO3)为____。
(2)下列关于该反应的说法正确的是_________(填选项字母)。
A.增加O2的浓度能加快反应速率
B.降低体系温度能加快反应速率
C.使用催化剂能加快反应速率
D.一定条件下达到反应限度时SO2全部转化为SO3
(3)在反应过程中,若某一时刻SO2、O2、SO3的浓度分别为0.2mol/L、0.1 mol/L、0.2mol/L。当反应达到平衡时,可能存在的数据是___________(填选项字母)。
A.O2为0.2mol/L B. SO2为0.25mol/L
C.SO3为0.4mol/L D. SO2、SO3均为0.15mol/L
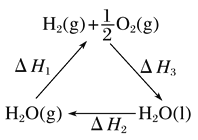
(4)FeS2焙烧产生的SO2可用于制硫酸。已知25℃、101KPa时:
2 SO2(g)+ O2(g)2SO3(g)△H1=-197kJmol-1;
H2O(g)═H2O(l)△H2=-44kJmol-1;
2SO2(g)+O2(g)+2H2O(g)═2H2SO4(l)△H3=-545kJmol-1
则SO3(g)与H2O(l)反应生成H2SO4(l)的热化学方程式是____________________。
(5)工业制硫酸,用过量的氨水对SO2进行尾气处理,该反应的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科学家利用二氧化铈(CeO2)在太阳能作用下将H2O、CO2转变为H2、CO。其过程如下:
mCeO2![]() (m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xO2
(m-x)CeO2·xCe+xH2O+xCO2![]() mCeO2+xH2+xCO
mCeO2+xH2+xCO
下列说法不正确的是( )
A. 该过程中CeO2没有消耗
B. 该过程实现了太阳能向化学能的转化
C. 如图中ΔH1=ΔH2+ΔH3
D. 以CO和O2构成的碱性燃料电池的负极反应式为CO+4OH--2e-=CO![]() +2H2O
+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下氨能被Cl2、Br2、H2O2等氧化,已知以下反应:8NH3+3Cl2→6NH4Cl+N2
已知该反应中,氨气不足时,也会有HCl产生。
(1)用单线桥标出电子转移的方向和数目。________
(2)这一反应中,氧化剂是________,氧化产物是________。
(3)若有3 mol N2生成,则发生氧化反应的物质有________mol。
(4)根据上述反应,若将浓氨水与Cl2靠近,将会看到______________________(现象)。
(5)当0.5LNH3与0.3LCl2充分反应后,气体的体积变为________L,若收集一瓶该产物气体,并使用该气体进行喷泉实验,并用紫色石蕊溶液作指示剂,最终溶液呈________色。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
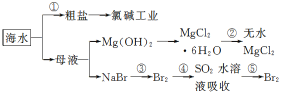
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了制取并提纯Br2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com