
【题目】下列说法正确的是( )
A.升高温度,Al2(SO4)3溶液的pH增大。
B.室温下,CuSO4溶液pH<7,因此向纯水中加入CuSO4会抑制水的电离。
C.Na2SiO3溶液加热、蒸干、灼烧后所得固体的成分是SiO2。
D.相同温度下,AgCl在相同物质的量浓度的CaCl2和NaCl溶液中的溶解度不同。
【答案】D
【解析】
试题分析:A、Al3+发生水解,Al3++3H2O![]() Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进电离,c(H+)增大,pH降低,故错误;B、CuSO4属于强酸弱碱盐,Cu2+发生水解,Cu2++2H2O
Al(OH)3+3H+,盐类水解是吸热反应,升高温度,促进电离,c(H+)增大,pH降低,故错误;B、CuSO4属于强酸弱碱盐,Cu2+发生水解,Cu2++2H2O![]() Cu(OH)2+2H+,c(H+)>c(OH-),溶液显酸性,即pH<7,盐类水解,促进水的电离,故错误;C、发生SiO32-+2H2O
Cu(OH)2+2H+,c(H+)>c(OH-),溶液显酸性,即pH<7,盐类水解,促进水的电离,故错误;C、发生SiO32-+2H2O![]() H2SiO3+2OH-,加热虽然促进水解,但蒸干、灼烧后,固体仍为Na2SiO3,故错误;D、相同浓度时,CaCl2溶液中c(Cl-)是NaCl溶液中c(Cl-)的2倍,根据Ksp(AgCl)=c(Ag+)×c(Cl-),因此AgCl在CaCl2溶液中的溶解度小于在NaCl溶液的溶解度,故正确。
H2SiO3+2OH-,加热虽然促进水解,但蒸干、灼烧后,固体仍为Na2SiO3,故错误;D、相同浓度时,CaCl2溶液中c(Cl-)是NaCl溶液中c(Cl-)的2倍,根据Ksp(AgCl)=c(Ag+)×c(Cl-),因此AgCl在CaCl2溶液中的溶解度小于在NaCl溶液的溶解度,故正确。


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】已知某温度下CH3COOH和NH3·H2O的电离常数相等,现向10 mL浓度为0.1 mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中 ( )。
A.水的电离程度始终增大
B.![]() 先增大再减小
先增大再减小
C.c(CH3COOH)与c(CH3COO-)之和始终保持不变
D.当加入氨水的体积为10 mL时,c(NH![]() )=c(CH3COO-)
)=c(CH3COO-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属铝分别和O2、O3反应生成Al2O3,反应过程和能量关系如图所示(图中的△H表示生成1mol产物的数据)。下列有关说法中不正确的是
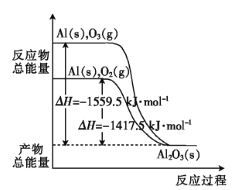
A. Al(s)与O3(g)反应的热化学方程式为2Al(s)+O3(g)=Al2O3(s) ΔH=-1559.5kJ·mol-1
B. 等质量的O2比O3的能量低,O2比O3稳定
C. 1 mol O2完全转化为O3,需吸收142 kJ的热量
D. Al(s)与O2(g)反应的热化学方程式为4Al(s)+3O2(g)=2Al2O3(s) ΔH=-2835kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)图1表示10mL量筒中液面的位置,A与B,B与C刻度间相差1mL, 如果刻度A为4,量简中液体的体积是__________mL。
(2)图II表示50mL滴定管中液画的位置,如果液面处的读数是a ,则滴定管中液体的体积(填代号)________。
A. 是amL B.是(50-a)mL
C. 一定大于amL D.一定大于(50-a)mL
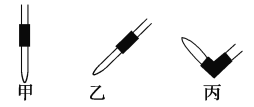
(3)排去碱式滴定管中气泡的方法应采用如图所示操作中的____________,然后轻轻挤压玻璃球使尖嘴部分充满碱液。

(4)实验室常利用甲醛法测定(NH4)2SO4样品中氮的质量分数,其反应原理为:
4NH4++6HCHO=3H++6H2O+(CH2)6N4H+
滴定时,1mol (CH2)6N4H+与1mol H+相当,然后用NaOH标准溶液滴定反应生成的酸。某兴趣小组用甲醛法进行了如下实验:
步骤I:称取样品1.500g。
步骤Ⅱ:将样品溶解后,完全转移到250mL容量瓶中,定容,充分摇匀。
步骤Ⅲ:移取25.00mL样品溶液于250mL锥形瓶中,加入10mL20%的中性甲醛溶液,摇匀、静置5min后,加入1~2滴酚酞试液,用NaOH标准溶液滴定至终点。按上述操作方法再重复2次。
(1)根据步骤Ⅲ填空:
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则测得样品中氮的质量分数 (填“偏高”、“偏低”或“无影响”)。
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积 (填“偏大”、“偏小”或“无影响”)。
③滴定时边滴边摇动锥形瓶,眼睛应观察 。
A 滴定管内液面的变化 B 锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由 色变成 色。
(2)滴定结果如下表所示:
滴定次数 | 待测溶液的 体积/mL | 标准溶液的体积 | |
滴定前刻度/mL | 滴定后刻度/mL | ||
1 | 25.00 | 1.02 | 21.03 |
2 | 25.00 | 2.00 | 21.99 |
3 | 25.00 | 0.20 | 20.20 |
若NaOH标准溶液的浓度为0.1010mo1·L-1,则该样品中氮的质量分数为 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】过氧化氢和臭氧是用途很广的氧化剂。试回答下列问题:
(1)过氧化氢是一种绿色氧化剂,写出在酸性条件下H2O2氧化KI的离子反应方程式:________________
(2)Na2O2 、K2O2、 以及BaO2都可与酸作用生成过氧化氢,目前实验室制取过氧化氢可通过上述某种过氧化物与适量稀硫酸作用,过滤即可制得。最适合的过氧化物是___________(写电子式),
(3)火箭发射常以液态肼(N2H4)为燃料,液态过氧化氢为助燃剂.
已知:N2H4(g)+O2(g)=N2(g)+2H2O(l) △H=-534kJ mol-1
H2O2(l)=H2O(l)+1/2O2(g) △H=-98.64kJ mol-1
H2O(l)=H2O(g) △H=+44kJ mol-1
则反应N2H4(g)+2H2O2(l)= N2(g)+4H2O(g) 的 △H=____________
(4)臭氧(O3)可以使湿润的淀粉-碘化钾试纸变蓝,反应的化学方程式为:____________________
KI+O3+H2O→KOH+I2+O2(未配平)回答问题:
还原产物的化学式为________________
②配平后的化学方程式是____________________
(4)O3 可由臭氧发生器(原理如图8所示)电解稀硫酸制得。
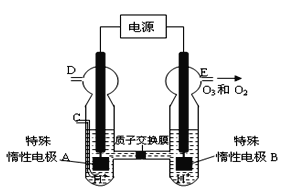
①图中阴极为 (填“A”或“B”)。
②若C处不通入O 2 ,D、E处分别收集到11.2L和有4.48L气体(标准状况下), 则E处收集的气体中O3所占的体积分数为 (忽略 O 3 的分解)。
③若C处通入O 2,则A极的电极反应式为: 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组离子中,能在同一溶液中大量共存,且溶液无色,加入一小块钠粒后仍能大量共存的是( )
A.K+、MnO4-、SO42-、H+ B.Na+、NO3-、K+、Cl-
C.Ba2+、Na+、HCO3-、NO3- D.Ca2+、NO3-、Cl-、CO32-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 某有机物燃烧只生成CO2和H2O,且二者的物质的量相等,则此有机物的组成为CnH2n
B. 相同质量的烃,完全燃烧,烃中碳的百分含量越高,消耗O2越少
C. 某气态 CxH4若与足量O2完全反应,则反应前后气体体积不变
D .烃在足量的氧气中燃烧并通过浓H2SO4,减少的体积就是生成的水蒸气的体积
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com