
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
【答案】2:7 Na2CrO4和Fe2O3 SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑
Na2SiO3+ CO2↑ ![]() 、5、6H+、2、5 O2↑、8 CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2 0.25mol/L Al3++3HCO3—=Al(OH)3↓+3 CO2↑
、5、6H+、2、5 O2↑、8 CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2 0.25mol/L Al3++3HCO3—=Al(OH)3↓+3 CO2↑
【解析】
(1)1mol FeO·Cr2O3参与反应共失去7mol电子,而1mol NaNO3参与反应得到2mol电子,根据得失电子守恒,可求出二者的化学计量数之比;由价态变化,可确定氧化产物。该步骤不能使陶瓷容器是因为SiO2和Na2CO3在高温下能发生反应;
(2)双氧水中氧元素的化合价从![]() 价升高到0价,失去1个电子,而高锰酸钾中锰元素的化合价从
价升高到0价,失去1个电子,而高锰酸钾中锰元素的化合价从![]() 价降低到
价降低到![]() 价,得到2个电子,根据电子的得失守恒,可得配平后的反应;
价,得到2个电子,根据电子的得失守恒,可得配平后的反应;
(3)Na2CO3溶液中通入足量Cl2,能发生反应生成氯化钠、次氯酸、二氧化碳和水;
(4)0.03mol Fe3O4中FeO为0.03mol,溶于硫酸生成Fe2+,被20.00ml K2Cr2O7溶液全部氧化转化为Fe3+,依据得失电子数目守恒计算K2Cr2O7的物质的量浓度;
(5)氯化铝与碳酸氢钠相发生双水解反应生成氢氧化铝沉淀和二氧化碳气体。
(1)1mol FeO·Cr2O3参与反应共失去7mol电子,而1mol NaNO3参与反应得到2mol电子,根据得失电子守恒,二者的化学计量数比为2:7,氧化产物为Na2CrO4和Fe2O3,该步骤不能使陶瓷容器是因为SiO2和Na2CO3在高温下能发生反应生成硅酸钠和二氧化碳,反应的化学方程式为SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑,故答案为:2:7; Na2CrO4和Fe2O3;SiO2+ Na2CO3
Na2SiO3+ CO2↑,故答案为:2:7; Na2CrO4和Fe2O3;SiO2+ Na2CO3 ![]() Na2SiO3+ CO2↑;
Na2SiO3+ CO2↑;
(2)双氧水中氧元素的化合价从![]() 价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从
价升高到0价,失去1个电子。而高锰酸钾中锰元素的化合价从![]() 价降低到
价降低到![]() 价,得到2个电子,根据电子的得失守恒可知,配平后的反应为2MnO4—+5H2O2+6H+=2Mn2++5 O2↑+8H2O ,故答案为:
价,得到2个电子,根据电子的得失守恒可知,配平后的反应为2MnO4—+5H2O2+6H+=2Mn2++5 O2↑+8H2O ,故答案为:![]() 、5、6H+、2、5 O2↑、8;
、5、6H+、2、5 O2↑、8;
(3)Na2CO3溶液中通入足量Cl2,能发生反应生成氯化钠、次氯酸、二氧化碳和水,反应的离子反应方程式为CO32—+2 Cl2+H2O=2Cl—+2HClO+ CO2,故答案为:CO32—+2Cl2+H2O=2Cl—+2HClO+ CO2;
(4)0.03mol Fe3O4中FeO为0.03mol,溶于硫酸生成Fe2+,被20.00ml K2Cr2O7溶液全部氧化转化为Fe3+,依据得失电子数目守恒可得0.03mol×1=c(K2Cr2O7)×2×0.2L,解得c(K2Cr2O7)=0.25mol/L,答案为:0.25mol/L;
(5)氯化铝与碳酸氢钠相发生双水解反应生成氢氧化铝沉淀和二氧化碳气体,反应的离子方程式为Al3++3HCO3—=Al(OH)3↓+3 CO2↑,故答案为:Al3++3HCO3—=Al(OH)3↓+3 CO2↑。


科目:高中化学 来源: 题型:
【题目】一定条件下,向2L密闭容器中加入2molN2和10molH2,发生反应N2(g)+3H2(g)![]() 2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
2NH3(g),2min时测得剩余N2为1mol,下列化学反应速率表示不正确的是( )
A. v(N2)=0.25 mol·L-1·min-1
B. v(H2)=0.75 mol·L-1·min-1
C. v(NH3)=1 mol·L-1·min-1
D. v(NH3)=0.5 mol·L-1·min-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是

A. 配平后的化学计量数依次为3、1、2、6、3
B. 若有1mol的S被氧化,则生成2mol S2-
C. 氧化剂与还原剂的物质的量之比为1:2
D. 2mol的S参加反应有3mol的电子转移
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(I)![]() 和
和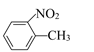 的一些物理性质如下表:
的一些物理性质如下表:
物质 | 熔点 | 沸点 | 密度 | 水溶性 |
| -10℃ | 212℃ | 1.1622g/mL | 不溶于水 |
| 54℃ | 238℃ | 1.1581g/mL | 不溶于水 |
①分离这两种物质混合物可采用的方法是__。(填序号)
A.过滤 B.分液 C.蒸发 D.分馏
②实验需要用到的主要玻璃仪器是___。
(II)酯是重要的有机合成中间体,广泛应用于溶剂、增塑剂、香料、粘合剂及印刷、纺织等工业。乙酸乙酯的实验室和工业制法常采用如下反应:CH3COOH+C2H5OH![]() CH3COOC2H5+H2O
CH3COOC2H5+H2O
请根据要求回答下列问题:
(1)欲提高乙酸的转化率,可采取的措施有___、___等。
(2)若用如图所示装置来制备少量的乙酸乙酯,产率往往偏低,其原因可能为___、___。
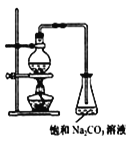
(3)此反应以浓硫酸为催化剂,可能会造成___、__问题。
(4)目前对该反应的催化剂进行了新的探索,初步表明质子酸离子液体可用作反应的催化剂,且能重复使用。实验数据如下表所示(乙酸和乙醇以等物质的量混合)
同一反应时间 | 同一反应温度 | ||||
反应温度/℃ | 转化率(%) | 选择性(%) | 反应时间/h | 转化率(%) | 选择性(%) |
40 | 77.8 | 100 | 2 | 80.2 | 100 |
60 | 92.3 | 100 | 3 | 87.8 | 100 |
80 | 92.6 | 100 | 4 | 92.3 | 100 |
120 | 94.5 | 98.7 | 6 | 93.0 | 100 |
选择性100%表示反应生成的产物是乙酸乙酯和水 | |||||
根据表中数据,下列___(填字母)为该反应的最佳条件。
A.120℃,4h B.80℃,2h
C.60℃,4h D.40℃,3h
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 七种物质:
七种物质:
(1)写出一个包含上述七种物质的氧化还原反应方程式:____________。
(2)上述反应中,1mol氧化剂在反应中得到________mol电子。
(3)如果在反应后的溶液中加入![]() ,溶液又变紫红色。已知铋有
,溶液又变紫红色。已知铋有![]() 、
、![]() 价,其中
价,其中![]() 价较稳定,写出加入
价较稳定,写出加入![]() 溶液又变紫红色的离子方程式:_________。由上述方程式说明
溶液又变紫红色的离子方程式:_________。由上述方程式说明![]() 的一个性质:__________。
的一个性质:__________。
II.(1)已知![]() 能与次氯酸盐发生如下反应(未配平)
能与次氯酸盐发生如下反应(未配平)![]() 。
。
①已知有10.7gFe(OH)3参加反应,共转移了![]() 个电子,则
个电子,则![]() ________。
________。
②根据所学的知识,推测![]() 能和下列________
能和下列________![]() 填序号
填序号![]() 物质反应。
物质反应。
A.![]() B.SO2 C.
B.SO2 C.![]() D.
D.![]()
(2)一定条件下,向含硝酸的废水中加入![]() ,将
,将![]() 还原成
还原成![]() 。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝及其化合物在生活、生产中有广泛应用。
(1)![]() 是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用氢氟酸、
是冰晶石的主要成分,冰晶石常作工业冶炼铝的助熔剂。工业上,用氢氟酸、![]() 和
和![]() 制备冰晶石。化学反应为
制备冰晶石。化学反应为![]() 。稳定性:HF______
。稳定性:HF______![]() 填“
填“![]() ”或“
”或“![]() ”
”![]() ,上述反应不能在玻璃容器中进行,其原因是________________
,上述反应不能在玻璃容器中进行,其原因是________________![]() 用化学方程式表示
用化学方程式表示![]() 。
。
(2)明矾![]() 常作净水剂。明矾溶液呈______
常作净水剂。明矾溶液呈______![]() 填“酸”“中”或“碱”
填“酸”“中”或“碱”![]() 性,向明矾溶液中滴加氢氧化钡溶液至
性,向明矾溶液中滴加氢氧化钡溶液至![]() 恰好完全沉淀,写出该反应的离子方程式: ______________。
恰好完全沉淀,写出该反应的离子方程式: ______________。
(3)铝合金材料耐酸、碱等腐蚀,广泛应用于生活、建筑等方面。工业上,常采用氧化法增厚铝合金材料表面的氧化膜,如常温下,用铬酸![]() 作氧化剂可以使氧化膜产生美丽的颜色
作氧化剂可以使氧化膜产生美丽的颜色![]() 还原产物为
还原产物为![]() ,配平化学方程式:______________
,配平化学方程式:______________![]() ______
______![]() ______
______![]() ______
______![]() ______
______![]() 。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等
。等质量的铁、铝、硅组成的同种合金分别与足量盐酸、足量烧碱溶液反应,产生氢气体积相等![]() 同温同压
同温同压![]() ,则该合金中铁、硅的质量之比为______。
,则该合金中铁、硅的质量之比为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 和
和![]() 六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
六种粒子,属于同一氧化还原反应中的反应物和生成物,下列叙述不正确的是
A.被氧化和被还原的离子数目比为![]()
B.该反应说明![]() 、
、![]() 、、
、、![]() 在溶液不能大量共存
在溶液不能大量共存
C.每![]() 发生氧化反应,转移
发生氧化反应,转移![]()
D.若利用该反应设计原电池,则负极反应为:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】无色气体N2O4是一种强氧化剂,为重要的火箭推进剂之一。N2O4与NO2转换的热化学方程式为:N2O4(g)![]() 2NO2(g)△H=+24.4kJ/mol。
2NO2(g)△H=+24.4kJ/mol。
(1)将一定量N2O4投入固定容积的真空容器中,下述现象能说明反应达到平衡的是_________________(填写代号)。
a.υ正(N2O4)=2υ逆(NO2) b.体系颜色不变
c.气体平均相对分子质量不变 d.气体密度不变
达到平衡后,保持体积不变升高温度,再次到达平衡时,则混合气体颜色________(填“变深”、“变浅”或“不变”)判断理由是____________________________________________________________________。
(2)上述反应中,正反应速率υ正=k正·p(N2O4),逆反应速率υ逆=k逆·p2(NO2),其中k正、k逆为速率常数,p(N2O4),p(NO2)为N2O4,NO2的分压,分压=总压×物质的量分数,则Kp为_________(以k正、k逆表示)。若将一定量N2O4投入真空容器中恒温恒压分解(温度298K、压强100kPa),已知该条件下k正=4.8×l04s-1,当N2O4分解10%时,υ正=___________kPa·s-1。
(3)真空密闭容器中放入一定量N2O4,维持总压强p0恒定,在温度为T时,平衡时N2O4分解百分率为α。保持温度不变,向密闭容器中充入等量N2O4,维持总压强在2p0条件下分解,则N2O4的平衡分解率的表达式为(用α表示)_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解法制备MnO2的装置如图。下列说法错误的是

A. 离子交换膜可选用质子交换膜
B. 阳极反应式为Mn2++2H2O-2e-= MnO2+4H+
C. 阴极区溶液的PH增大
D. 导线中通过1mol电子时,理论上阳极区溶液质量减少44.5g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com