
【题目】把图二的碎纸片补充到图一中,可得到一个完整的离子方程式。对该离子方程式说法正确的是

A. 配平后的化学计量数依次为3、1、2、6、3
B. 若有1mol的S被氧化,则生成2mol S2-
C. 氧化剂与还原剂的物质的量之比为1:2
D. 2mol的S参加反应有3mol的电子转移
科目:高中化学 来源: 题型:
【题目】(1)如图所示,若C为浓硝酸,电流表指针发生偏转,B电极材料为Fe ,A电极材料为Cu,则B电极的电极反应式为___________,A电极的电极反应式为_______;反应进行一段时间后溶液C的pH将___ (填“升高”“降低”或“基本不变”)。
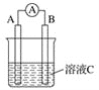
(2)我国首创以铝空气海水电池作为能源的新型的海水标志灯,以海水为电解质溶液,靠空气中的氧气使铝不断氧化而产生电流,只要把灯放入海水数分钟,就会发出耀眼的白光。则电源的负极材料是____,负极反应为___________;正极反应为_____________________________。
(3)熔盐电池具有高的发电效率,因而受到重视,可用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,制得在650 ℃下工作的燃料电池,完成有关电池反应式。负极反应式为2CO+2CO32--4e-=4CO2,正极反应式为___________,电池总反应式为_______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴化钙晶体(CaBr2·2H2O)为白色固体,易溶于水,可用于制造灭火剂、制冷剂等。一种制备溴化钙晶体的工艺流程如下:
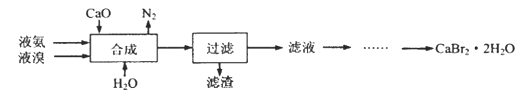
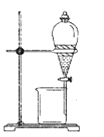
(1)实验室模拟海水提溴的过程中,用苯萃取溶液中的溴,分离溴的苯溶液与水层的操作是(装置如下图):使玻璃塞上的凹槽对准漏斗上的小孔,将活塞拧开,使下面的水层慢慢流下,待有机层和水层界面与活塞上口相切即关闭活塞,______________。
(2)“合成”的化学方程式为___________________。 “合成”温度控制在70℃以下,其原因是__________。投料时控制n(Br2):n(NH3)= 1:0.8,其目的是__________________。
(3)“滤渣”的主要成分为_________________(填化学式)。
(4)“滤液”呈强碱性,其中含有少量BrO-、BrO3-,请补充从“滤液”中提取CaBr2·2H2O的实验操作:加热驱除多余的氨,______________。[实验中须使用的试剂有:氢溴酸、活性炭、乙醇;除常用仪器外须使用的仪器有:砂芯漏斗,真空干燥箱]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国古代四大发明之一——黑火药,它在爆炸时发生的化学反应为2KNO3+3C+S=A+N2↑+3CO2↑(已配平)
(1)①除S外,上列元素的电负性从大到小依次为__________。
②在生成物中,A的晶体类型为_______,含极性共价键的分子的中心原子轨道杂化类型为_____。
③已知CN-与N2互为等电子体,推算HCN分子中σ键与π键数目之比为_____。
(2)原子序数小于36的元素Q和T,在周期表中既处于同一周期又位于同一族,且原子序数T比Q多2。T的基态原子外围电子(价电子)排布为______,Q2+的未成对电子数是_______。
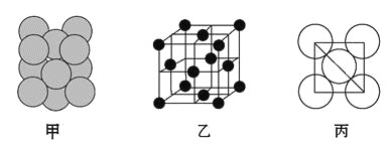
(3)若某金属单质晶体中原子的堆积方式如图甲所示,其晶胞特征如图乙所示,原子之间相互位置关系的平面图如图丙所示。则晶胞中该原子的配位数为________,该单质晶体中原子的堆积方式为四种基本堆积方式中的________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
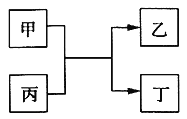
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某有机物结构如图,下列说法中正确的是![]()

A. 该物质的化学式为C15H8O8BrCl
B. 该物质能与![]() 溶液发生显色反应
溶液发生显色反应
C. 1mol该物质最多能与3mol溴水发生加成反应
D. 一定条件下,1mol该物质最多能与8molNaOH反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】羟氡(NH2OH)为一元弱碱(25℃时,电离常数Kb=9.0×l0-9),其电离方程式为:NH2OH+H2O![]() NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
NH3OH++OH-。用0.lmol/L盐酸滴定20mL0.lmol/L NH2OH溶液,恒定25℃时,滴定过程中由水电离出来的H+浓度的负对数与盐酸体积的关系如图所示(己知:lg3=0.5)。下列说法不正确的是( )
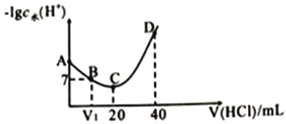
A. A、B、C、D四点对应的溶液中NH2OH电离常数相等
B. A点对应溶液的pH=9.5
C. D点对应溶液中存在:c(H+)=c(OH-)+c(NH3OH+)+c(NH2OH)
D. C点时,溶液呈酸性
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com