
【题目】Ⅰ.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 七种物质:
七种物质:
(1)写出一个包含上述七种物质的氧化还原反应方程式:____________。
(2)上述反应中,1mol氧化剂在反应中得到________mol电子。
(3)如果在反应后的溶液中加入![]() ,溶液又变紫红色。已知铋有
,溶液又变紫红色。已知铋有![]() 、
、![]() 价,其中
价,其中![]() 价较稳定,写出加入
价较稳定,写出加入![]() 溶液又变紫红色的离子方程式:_________。由上述方程式说明
溶液又变紫红色的离子方程式:_________。由上述方程式说明![]() 的一个性质:__________。
的一个性质:__________。
II.(1)已知![]() 能与次氯酸盐发生如下反应(未配平)
能与次氯酸盐发生如下反应(未配平)![]() 。
。
①已知有10.7gFe(OH)3参加反应,共转移了![]() 个电子,则
个电子,则![]() ________。
________。
②根据所学的知识,推测![]() 能和下列________
能和下列________![]() 填序号
填序号![]() 物质反应。
物质反应。
A.![]() B.SO2 C.
B.SO2 C.![]() D.
D.![]()
(2)一定条件下,向含硝酸的废水中加入![]() ,将
,将![]() 还原成
还原成![]() 。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
【答案】![]()
![]()
![]()
![]() 的氧化性比
的氧化性比![]() 的氧化性强
的氧化性强 ![]()
![]()
![]()
【解析】
Ⅰ(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,说明高锰酸钾可以将盐酸氧化为氯气。同理,高锰酸钾在酸性条件下可以将氯离子氧化为氯气;
(2)在反应中,![]() 作氧化剂,反应前后,Mn元素的化合价由
作氧化剂,反应前后,Mn元素的化合价由![]() 价降低为
价降低为![]() 价,由此可求出1molKMnO4在反应中得到电子的物质的量;
价,由此可求出1molKMnO4在反应中得到电子的物质的量;
(3)在反应后的溶液中加入![]() ,溶液又变紫红色,说明
,溶液又变紫红色,说明![]() 将二价锰离子氧化为高锰酸根离子;根据同一反应中氧化剂的氧化性强于氧化产物的氧化性可得:
将二价锰离子氧化为高锰酸根离子;根据同一反应中氧化剂的氧化性强于氧化产物的氧化性可得:![]() 的氧化性比
的氧化性比![]() 的氧化性强,可写出反应方程式;
的氧化性强,可写出反应方程式;
Ⅱ.(1)①10.7gFe(OH)3的物质的量为![]() ,转移
,转移![]() 个电子,即Fe元素化合价升高3价,从而求出n值;
个电子,即Fe元素化合价升高3价,从而求出n值;
②根据所学的知识,推测![]() 中Fe元素的化合价为
中Fe元素的化合价为![]() 价,有较强的氧化性,可以和还原性物质反应,从而确定还原剂;
价,有较强的氧化性,可以和还原性物质反应,从而确定还原剂;
(2) 32gCH3OH的物质的量为:![]() ,作还原剂,转移6mol电子,而1molHNO3作氧化剂转化为
,作还原剂,转移6mol电子,而1molHNO3作氧化剂转化为![]() 转移5mol电子,从而求出参加反应的还原剂和氧化剂的物质的量之比。
转移5mol电子,从而求出参加反应的还原剂和氧化剂的物质的量之比。
Ⅰ(1)已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去,说明高锰酸钾可以将盐酸氧化为氯气,则同理,高锰酸钾在酸性条件下可以将氯离子氧化为氯气,得出方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(2)在反应![]() 中,
中,![]() 作氧化剂,反应前后,Mn元素的化合价由
作氧化剂,反应前后,Mn元素的化合价由![]() 价降低为
价降低为![]() 价,
价,![]() 在反应中得到5mol电子,故答案为:5;
在反应中得到5mol电子,故答案为:5;
(3)在反应后的溶液中加入![]() ,溶液又变紫红色,说明
,溶液又变紫红色,说明![]() 将二价锰离子氧化为高锰酸根离子,反应的离子方程式为:
将二价锰离子氧化为高锰酸根离子,反应的离子方程式为:![]() ;根据同一反应中氧化剂的氧化性强于氧化产物的氧化性可得:
;根据同一反应中氧化剂的氧化性强于氧化产物的氧化性可得:![]() 的氧化性比
的氧化性比![]() 的氧化性强,故答案为:
的氧化性强,故答案为:![]() ;
;![]() 的氧化性比
的氧化性比![]() 的氧化性强;
的氧化性强;
Ⅱ①10.7gFe(OH)3的物质的量为![]() ,转移
,转移![]() 个电子,即Fe元素化合价升高3价,则
个电子,即Fe元素化合价升高3价,则![]() ,故答案为:2;
,故答案为:2;
②根据所学的知识,推测![]() 中Fe元素的化合价为
中Fe元素的化合价为![]() 价,有较强的氧化性,可以和还原性物质反应,而AD两项是常见的氧化剂,BC两项是常见的还原剂,故答案为:BC;
价,有较强的氧化性,可以和还原性物质反应,而AD两项是常见的氧化剂,BC两项是常见的还原剂,故答案为:BC;
(2) 32gCH3OH的物质的量为:![]() ,作还原剂,转移6mol电子;而1molHNO3作氧化剂转化为
,作还原剂,转移6mol电子;而1molHNO3作氧化剂转化为![]() 转移5mol电子,则参加反应的还原剂和氧化剂的物质的量之比是
转移5mol电子,则参加反应的还原剂和氧化剂的物质的量之比是![]() ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】水的电离平衡如图所示.

(1)若A点表示25℃时水的电离平衡状态,当升高温度至100℃时水的电离平衡状态为B点,则此时水的离子积为___________
(2)将100℃时pH=8的Ba(OH)2溶液与pH=5的盐酸混合,并保持100℃的恒温,欲使混合溶液的pH=7,则Ba(OH)2溶液与盐酸的体积比为_________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙、丙、丁为中学常见物质,其中甲、乙为单质,丙为氧化物,它们之间存在如图所示的转化关系:
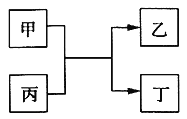
下列说法正确的是( )
A. 若甲、乙元素是同主族元素,根据元素周期表推测,此时乙单质可能是Si
B. 若甲、乙均为金属单质,则丁所属的物质类别一定是碱性氧化物
C. 若甲为金属单质,乙为非金属单质,则甲只能是Mg
D. 若甲、乙元素是同周期元素,则该反应的化学方程式一定为:2F2 + 2H2O=4HF + O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求作答
(1)钴位于元素周期表的第__族,其基态原子中未成对电子个数为__。
(2)[Fe(H2NCONH2)6](NO3)3的名称是三硝酸六尿素合铁(Ⅲ),是一种重要的配合物。该化合物中Fe3+的核外电子排布式为__,所含非金属元素的电负性由大到小的顺序是__。
(3)尿素[CO(NH2)2]分子中σ键与π键的数目之比为__。
(4)硒、硅均能与氢气化合形成气态氢化物,若“Si-H”中共用电子对偏向氢,氢气与硒反应时,硒单质做氧化剂,则硒与硅的电负性大小为Se__Si(填“>”或“<”)
(5)与Si同周期部分元素的逐级电离能如图所示,其中a、b和c分别代表__。

A.a为I1、b为I2、c为I3 B.a为I2、b为I3、c为I1
C.a为I3、b为I2、c为I1 D.a为I1、b为I3、c为I2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如图:
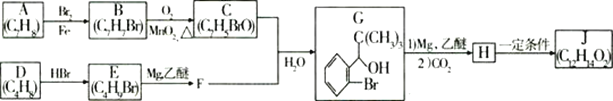
已知:①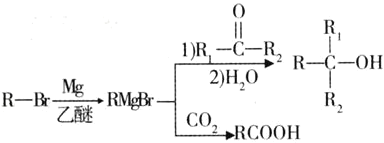
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
④J是一种酯,分子中除苯环外还含有一个五元环
⑤苯环上的卤原子在常压下遇到NaOH的溶液很难水解
回答下列问题:
(1)G中官能团的名称:___、__。
(2)D的系统命名是__;J的结构简式为__。
(3)由A生成B的化学方程式为__,反应类型为__。
(4)C与新制的氢氧化铜悬浊液反应的化学方程式为__。
(5)H在一定条件下生成高分子化合物的结构简式为__。
(6)G的同分异构体中核磁共振氢谱有4组峰,且能与FeCl3溶液发生显色反应,任写出其中两种符合上述条件的同分异构体的结构简式__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求填空:
(1)FeO·Cr2O3+NaNO3![]() Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
Na2CrO4+ Fe2O3+ CO2↑+NaNO2,上述反应配平后,FeO·Cr2O3与NaNO3的系数比为________,该反应的氧化产物为_____________,该步骤不能使陶瓷容器,用反应式说明:_________。
(2)完成下列反应_____ MnO4—+H2O2+___=Mn2++__+H2O。
(3)Na2CO3溶液中通入足量Cl2,写出其离子反应方程式:_______________。
(4)将0.03mol Fe3O4完全溶解在200ml3. 00mol/L硫酸中,然后加入20.00ml K2Cr2O7溶液,
恰好使Fe2+全部转化为Fe3+,且Cr2O72—中的铬全部转化为Cr3+,则, K2Cr2O7的物质的量浓度是________。
(5)用离子反应方程式表示泡沫灭火器的反应原理:__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 将0.10 mol·L-1氨水加水稀释后,溶液中c(NH![]() )·c(OH-)变大
)·c(OH-)变大
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. 将CH3COOH溶液加水稀释后,溶液中![]() 变大
变大
D. 用0.200 0 mol·L-1NaOH标准溶液滴定HCl与CH3COOH的混合溶液(混合溶液中两种酸的浓度均为0.1 mol·L-1),至中性时,溶液中的酸未被完全中和
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在混合体系中,确认化学反应先后顺序有利于问题的解决,下列反应先后顺序判断正确的是( )
A.在含等物质的量的FeBr2、FeI2的溶液中缓慢通入Cl2:![]() 、
、![]() 、
、![]()
B.在含等物质的量的![]() 、
、![]() 、
、![]() 的溶液中加入Zn:
的溶液中加入Zn:![]() 、
、![]() 、
、![]() 、
、![]()
C.在含等物质的量的![]() 、KOH的溶液中通入
、KOH的溶液中通入![]() :
:![]() 、KOH、BaCO3、
、KOH、BaCO3、![]()
D.在含等物质的量的AlO2-、![]() 、
、![]() 溶液中,逐滴加入盐酸:
溶液中,逐滴加入盐酸:![]() 、
、![]() 、AlO2-、
、AlO2-、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,浓度均为![]() 的4种钠盐溶液pH如下:下列说法不正确的是( )
的4种钠盐溶液pH如下:下列说法不正确的是( )
溶质 |
|
| NaClO |
|
pH |
|
|
|
|
A.四种溶液中,![]() 溶液中水的电离程度最大
溶液中水的电离程度最大
B.![]() 溶液显酸性的原因是:
溶液显酸性的原因是:![]()
C.向氯水中加入少量![]() ,可以增大氯水中次氯酸的浓度
,可以增大氯水中次氯酸的浓度
D.常温下,相同物质的量浓度的![]() 、
、![]() 、HClO,pH最小的是
、HClO,pH最小的是![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com