
【题目】丁苯酞(J)是治疗轻、中度急性脑缺血的药物,合成J的一种路线如图:
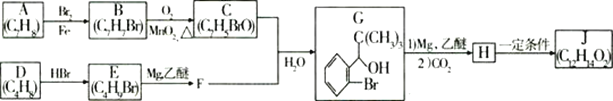
已知:①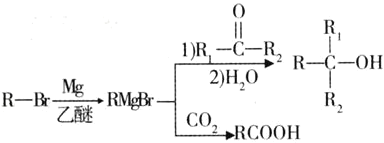
②E的核磁共振氢谱只有一组峰
③C能发生银镜反应
④J是一种酯,分子中除苯环外还含有一个五元环
⑤苯环上的卤原子在常压下遇到NaOH的溶液很难水解
回答下列问题:
(1)G中官能团的名称:___、__。
(2)D的系统命名是__;J的结构简式为__。
(3)由A生成B的化学方程式为__,反应类型为__。
(4)C与新制的氢氧化铜悬浊液反应的化学方程式为__。
(5)H在一定条件下生成高分子化合物的结构简式为__。
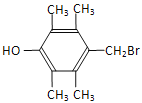
(6)G的同分异构体中核磁共振氢谱有4组峰,且能与FeCl3溶液发生显色反应,任写出其中两种符合上述条件的同分异构体的结构简式__。
【答案】羟基 溴原子 2-甲基-1-丙烯 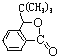
![]() +Br2
+Br2![]()
 +HBr 取代反应
+HBr 取代反应 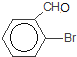 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
 +2Cu2O↓+3H2O
+2Cu2O↓+3H2O 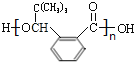
 、
、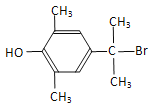 、
、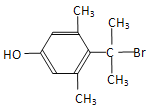 (任意2种)
(任意2种)
【解析】
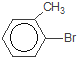
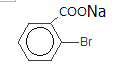
E的核磁共振氢谱只有一组峰,则E中9个H原子连接在相同环境的C原子上,其结构简式为CH3-CHBr(CH3)2;D、E具有相同的碳链结构,则D为CH2=C(CH3)2;G中含有苯环,则A、B、C中均含有苯环,C能发生银镜反应,则含有醛基,则C中的醛基与Br在苯环的相邻位置,即![]() ;则B为
;则B为![]() ,A为甲苯;根据已知及G的结构简式,H的结构简式为
,A为甲苯;根据已知及G的结构简式,H的结构简式为![]() ;H自身发生酯化反应,生成
;H自身发生酯化反应,生成![]() 。
。
(1)根据G的结构简式,含有官能团的名称为羟基、溴原子;
(2)D为CH2=C(CH3)2,其系统命名为2-甲基-1-丙烯;根据分析可知,J的结构简式为 ;
;
(3)A为甲苯,B为 ,A发生苯环上的取代反应生成B,则方程式为
,A发生苯环上的取代反应生成B,则方程式为![]() +Br2
+Br2![]()
 +HBr;
+HBr;
(4)C为 ,与新制的氢氧化铜悬浊液发生氧化反应,生成
,与新制的氢氧化铜悬浊液发生氧化反应,生成![]() 、氧化亚铜和水,化学方程式为
、氧化亚铜和水,化学方程式为 +2Cu(OH)2+NaOH
+2Cu(OH)2+NaOH![]()
![]() +2Cu2O↓+3H2O;
+2Cu2O↓+3H2O;
(5)H为![]() ,多个H发生缩聚反应生成高分子化合物,其结构简式为
,多个H发生缩聚反应生成高分子化合物,其结构简式为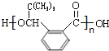 ;
;
(6)G的分子式为C11H9OBr,其同分异构体能与FeCl3溶液发生显色反应,则含有酚羟基;核磁共振氢谱有4组峰,羟基一种,苯环上由2种,且为对称结构,与羟基相对的支链1种,则可能结构简式为![]() 、
、![]() 、
、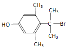 。
。


科目:高中化学 来源: 题型:
【题目】近期发现,H2S是继NO、CO之后的第三个生命体系气体信号分子,它具有参与调节神经信号传递、舒张血管减轻高血压的功能。常温时,H2S在水中的电离常数Ka1=1.3×10-7,Ka2=7.0×10-15。按要求回答下列问题:
(1)H2S在水中的二级电离常数表达式Ka2=______;0.1mol/LNa2S溶液中离子浓度由大到小的顺序为__________.
(2)常温下,向0.1mol/LH2S溶液中通入HCl或加入NaOH固体,测得c(S2-)与溶液pH的关系如图(忽略溶液体积的变化及H2S的挥发)。

①当溶液中c(S2-)=1.4×10-19mol/L时,溶液中c(OH-)=______,水电离产生的c(H+)=______.
②当pH=13时,溶液中的c(H2S)+c(HS-)=_______.
(3)在工业废水处理中常用H2S将Mn2+转化为MnS除去。常温下,向含有0.010mol·L-1 Mn2+废水中通入H2S以调节废水的pH,当c(HS-)=2.0×10-4mol·L-1时,Mn2+开始沉淀,此时废水的pH=___。[已知Ksp(MnS)=1.4×10-15]
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知X、Y和Z三种元素的原子序数之和等于42。X元素原子的4p轨道上有3个未成对电子,Y元素原子的最外层2p轨道上有2个未成对电子。X跟Y可形成化合物X2Y3,Z元素可以形成负一价离子。请回答下列问题:
(1)X元素原子基态时的电子排布式为__________,该元素的符号是__________;
 (2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(2)Y元素原子的价层电子的轨道表示式为________,该元素的名称是__________;
(3)X与Z可形成化合物XZ3,该化合物的空间构型为____________;
(4)已知化合物X2Y3在稀硫酸溶液中可被金属锌还原为XZ3,产物还有ZnSO4和H2O,该反应的化学方程式是_________________________________________________;
(5)比较X的氢化物与同族第二、第三周期元素所形成的氢化物稳定性、沸点高低并说明理由____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某高分子材料的结构如图所示:已知该高分子材料是由三种单体聚合而成的,以下与此高分子材料相关的说法正确的是( )

A.三种单体中有两种有机物互为同系物
B.三种单体都可以使溴水褪色,但只有两种能使酸性高锰酸钾溶液褪色
C.形成该高分子材料的单体![]() 中,所有原子一定处于同一平面
中,所有原子一定处于同一平面
D.该高分子材料是体型高分子,合成它的反应是加聚反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨是一种重要的化工原料,可以用来制备氮化硅![]() 、肼
、肼![]() 、氢氰酸
、氢氰酸![]() 。
。
(1)已知:
![]()
![]()
![]()
![]()
则反应![]() 的
的![]() ________
________![]() 用a、b、c、d表示
用a、b、c、d表示![]() 。
。
(2)肼的制备方法是用次氯酸钠氧化过量的氨。
已知![]() 水解的方程式为:
水解的方程式为:![]() 。常温下,该水解反应的平衡常数为
。常温下,该水解反应的平衡常数为![]() ,则
,则![]() 溶液的
溶液的![]() ________。
________。
(3)工业上利用氨气生产氢氰酸![]() 的反应为:
的反应为:![]()
①其他条件一定,达到平衡时,![]() 转化率随外界条件X变化的关系如图1所示。X代表的是________
转化率随外界条件X变化的关系如图1所示。X代表的是________![]() 填“温度”或“压强”
填“温度”或“压强”![]() 。
。

②其他条件一定,向![]() 密闭容器中加入
密闭容器中加入![]() 和
和![]() ,平衡时,
,平衡时,![]() 体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为
体积分数随n变化的关系如图所示。若反应从开始到a点所用时间为![]() ,该时间段内用
,该时间段内用![]() 的浓度变化表示的反应速率为________
的浓度变化表示的反应速率为________![]() ;平衡常数:
;平衡常数:![]() ________
________![]() 填“
填“![]() ”“
”“![]() ”或“
”或“![]() ”
”![]() 。
。
③工业上用电解法处理含氰电镀废水![]() 的装置如图所示。
的装置如图所示。

阳极产生的氯气与碱性溶液反应生成![]() ,
,![]() 将
将![]() 氧化的离子方程式为:__________________________________________________________若电解处理
氧化的离子方程式为:__________________________________________________________若电解处理![]() ,则阴极产生气体的体积
,则阴极产生气体的体积![]() 标准状况下
标准状况下![]() 为________L。
为________L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.已知将盐酸滴入高锰酸钾溶液中,产生黄绿色气体,而溶液的紫红色褪去。现有一个氧化还原反应的体系中共有KCl、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 、
、![]() 七种物质:
七种物质:
(1)写出一个包含上述七种物质的氧化还原反应方程式:____________。
(2)上述反应中,1mol氧化剂在反应中得到________mol电子。
(3)如果在反应后的溶液中加入![]() ,溶液又变紫红色。已知铋有
,溶液又变紫红色。已知铋有![]() 、
、![]() 价,其中
价,其中![]() 价较稳定,写出加入
价较稳定,写出加入![]() 溶液又变紫红色的离子方程式:_________。由上述方程式说明
溶液又变紫红色的离子方程式:_________。由上述方程式说明![]() 的一个性质:__________。
的一个性质:__________。
II.(1)已知![]() 能与次氯酸盐发生如下反应(未配平)
能与次氯酸盐发生如下反应(未配平)![]() 。
。
①已知有10.7gFe(OH)3参加反应,共转移了![]() 个电子,则
个电子,则![]() ________。
________。
②根据所学的知识,推测![]() 能和下列________
能和下列________![]() 填序号
填序号![]() 物质反应。
物质反应。
A.![]() B.SO2 C.
B.SO2 C.![]() D.
D.![]()
(2)一定条件下,向含硝酸的废水中加入![]() ,将
,将![]() 还原成
还原成![]() 。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
。若该反应消耗32gCH3OH,转移6mol电子,则参加反应的还原剂和氧化剂的物质的量之比是________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
CO2(g)+H2(g) ΔH=-41kJ·mol-1。相同温度下,在容积相同的两个恒温密闭容器中,加入一定量的反应物发生反应。相关数据如下:
容器编号 | 起始时各物质物质的量/mol | 达平衡过程体系能量的变化 | |||
CO | H2O | CO2 | H2 | ||
① | 1 | 4 | 0 | 0 | 放出热量:32.8kJ |
② | 0 | 0 | 1 | 4 | 热量变化:QkJ |
下列说法中,不正确的是( )
A.容器①中反应达平衡时,CO的转化率为80%
B.容器①中CO的转化率等于容器②中CO2的转化率
C.平衡时,两容器中CO2的浓度相等
D.容器①时CO的反应速率等于H2O的反应速率
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】类推思维是化学解题中常用的一种思维方法,下列有关反应方程式(或离子方程式)的类推正确的是( )
已知 | 类推 | |
A | 将Fe加入CuSO4溶液中: Fe + Cu2+ = Cu + Fe2+ | 将Na加入到CuSO4溶液中: 2Na + Cu2+ = Cu + 2Na+ |
B | 稀硫酸与Ba(OH)2溶液反应至溶液呈中性: 2H++SO42﹣+Ba2++2OH﹣=BaSO4↓+2H2O | NaHSO4溶液与Ba(OH)2溶液反应呈中性: 2H++SO42﹣+Ba++2OH﹣=BaSO4↓+2H2O |
C | 铁和氯气反应2Fe+3Cl2 | 铁和单质反应2Fe+3I2 |
D | 向Ca(ClO)2溶液中通入少量CO2: Ca2++2ClO﹣+CO2+H2O=CaCO3↓+2HClO | 向Ca(ClO)2溶液中通入少量SO2: Ca2++2ClO﹣+SO2+H2O=CaSO3↓+2HClO |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】醋酸溶液中存在电离平衡:CH3COOHCH3COO-+H+,下列叙述中不正确的是( )
A. 0.1 mol/L 的 CH3COOH 溶液中加水稀释,溶液中所有离子浓度均减小
B. 醋酸溶液中离子浓度的关系满足:c(H+) = c(CH3COO-) + c(OH- )
C. CH3COOH 溶液中加入少量 CH3COONa(s),平衡逆向移动
D. 常温下,pH = 2 的 CH3COOH 溶液与 pH = 12 的 NaOH 溶液等体积混合后,溶液的 pH < 7
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com