
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
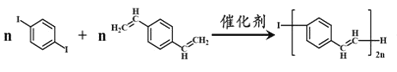 +(2n-1)HI
+(2n-1)HI
A.合成PPV的反应为加聚反应
B.1molPPV最多能与4 molH2发生加成反应
C. 与溴水加成后的产物最多有16个原子共平面
与溴水加成后的产物最多有16个原子共平面
D.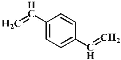 和苯乙烯互为同系物
和苯乙烯互为同系物
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】用压强传感器探究生铁在pH=2和pH=4醋酸溶液中发生腐蚀的装置及得到的图像如下:

分析图像,以下结论错误的是( )
A. 析氢腐蚀和吸氧腐蚀的速率一样快
B. 在酸性溶液中生铁可能发生吸氧腐蚀
C. 溶液pH≤2时,生铁发生析氢腐蚀
D. 两溶液中负极反应均为Fe – 2e- = Fe2+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知H2O2分解速率受多种因素影响,某小组对此进行探究,得到如下结果。下列说法不正确的是
序号 | H2O2体积(ml) | FeCl3体积(ml) | 混合溶液pH | 纯H2O2pH | 分解完全时间(s) |
1 | 20 | 10 | 1.00 | 2.92 | 几乎不分解 |
2 | 20 | 10 | 2.92 | 2.92 | 202 |
3 | 20 | 10 | 7.50 | 2.92 | 192 |
4 | 20 | 10 | 9.50 | 2.92 | 139 |
5 | 20 | 10 | 10.50 | 2.92 | 77 |
表1 (200C) | |||||
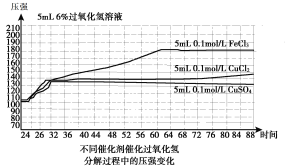
图1(200C)
A.表1表明,其他条件相同时,碱性条件下H2O2分解速率快于酸性条件下
B.图1表明,其他条件相同时,铜盐对H2O2分解的催化效果好于铁盐
C.图1表明,其他条件相同时,CuCl2对H2O2分解的催化效果好于CuSO4
D.以上实验表明,催化剂、溶液酸碱性对H2O2分解速率都有影响
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇是人们开发和利用的一种新能源。已知:
①2H2(g)+O2(g)=2H2O(l) △H1=-571.8kJ· mol-1
②CH3OH(g)+![]() O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
O2(g)=CO2(g)+2H2(g) △H=-192.9 kJ· mol-1
(1)甲醇蒸汽完全燃烧的热化学方程式为_____________。
(2)反应②中的能量变化如下图所示,则△H2=______(用E1和E2表示)。

(3)H2(g)的燃烧热为__________ kJ· mol-1。
(4)请你分析H2(g)作为能源比甲醇蒸汽作为能源的优点:__________________(写出一点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能正确表示下列反应的离子方程式的是( )
A.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2=2NH4++SO32-+H2O
B.Ca(HCO3)2溶液与少量NaOH溶液反应:Ca2++2HCO3-+2OH-=CaCO3↓+CO32-+2H2O
C.磁性氧化铁溶于足量稀硝酸: Fe3O4+8H+=Fe2++2Fe3++4H2O
D.明矾溶液中滴入Ba(OH)2溶液使SO42-恰好完全沉淀:2Ba2++3OH-+Al3++2SO42-=2BaSO4↓+Al(OH)3↓
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究碳、氮及其化合物的转化对于环境的改善有重大意义。
(1)氧化还原法消除NOx的转化如下:NO![]() NO2
NO2![]() N2
N2
已知:NO(g)+O3(g)===NO2(g)+O2(g) ΔH=-200.9 kJ·mol-1
2NO(g)+O2(g)===2NO2(g) ΔH=-116.2 kJ·mol-1
则反应Ⅰ的热化学方程式为___________________________________________________________。
(2)有人设想将CO按下列反应除去:2CO(g)===2C(s)+O2(g) ΔH>0,请你分析该设想能否实现?________(填“能”或“否”),依据是_________________________________________。
(3)一定条件下,CO可与粉末状的氢氧化钠作用生成甲酸钠。已知常温时,甲酸的电离平衡常数Ka=1.70×10-4。
①甲酸钠的水溶液呈碱性,请用离子方程式表示其原因________________________________________。
②向20 mL 0.1 mol·L-1的甲酸钠溶液中滴加10 mL 0.1 mol·L-1的盐酸,混合液呈________(填“酸”或“碱”)性,溶液中离子浓度从大到小的顺序为_________________________________。
(4)活性炭也可用于处理汽车尾气中的NO。在2 L恒容密闭容器中加入0.100 0 mol NO和2.030mol固体活性炭,生成A、B两种气体,在不同温度下测得平衡体系中各物质的物质的量如表所示:
温度 | 固体活性炭/mol | NO/mol | A/mol | B/mol |
200 ℃ | 2.000 | 0.040 0 | 0.030 0 | 0.030 0 |
335 ℃ | 2.005 | 0.050 0 | 0.025 0 | 0.025 0 |
①该反应的正反应为________(填“吸热”或“放热”)反应。
②200 ℃时,平衡后向恒容容器中再充入0.1 mol NO,再次平衡后,NO的百分含量将________(填“增大”“减小”或“不变”)。
③计算反应在335 ℃时的平衡常数为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列溶液中的离子关系正确的是( )
A.相同温度下,0.2 mol·L-1的醋酸溶液与0.l mol·L-1的醋酸溶液中c(H+)之比大于2 : 1
B.pH=3的醋酸和pH=3的FeCl3溶液中,由水电离出的c(H+)相等
C.0.l mol﹒L-1NaHSO4溶液中:c(H+)=c(SO![]() ) +c(OH-)
) +c(OH-)
D.pH=4、浓度均为0.l mol·L-1的CH3COOH、CH3COONa 混合溶液中:c(CH3COO-)-c(CH3COOH)=10-4-10-10mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥B.①②③C.①②⑤⑥D.①②③④⑤⑥
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com