
【题目】在一定温度下,可逆反应X(g)+3Y(g)![]() 2Z(g)达到平衡的标志是
2Z(g)达到平衡的标志是
①Z生成的速率与Z分解的速率相等 ②单位时间生成a mol X,同时生成3a mol Y
③X、Y、Z的浓度不再变化 ④X、Y、Z的分子数比为1:3:2
⑤X、Y、Z的浓度相等 ⑥X、Y、Z的质量不再发生变化
A.①③⑥B.①②③C.①②⑤⑥D.①②③④⑤⑥
 名师导航单元期末冲刺100分系列答案
名师导航单元期末冲刺100分系列答案 名校名卷单元同步训练测试题系列答案
名校名卷单元同步训练测试题系列答案科目:高中化学 来源: 题型:
【题目】合成导电高分子材料PPV的反应如下。下列说法正确的是( )
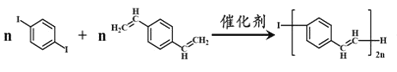 +(2n-1)HI
+(2n-1)HI
A.合成PPV的反应为加聚反应
B.1molPPV最多能与4 molH2发生加成反应
C. 与溴水加成后的产物最多有16个原子共平面
与溴水加成后的产物最多有16个原子共平面
D.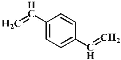 和苯乙烯互为同系物
和苯乙烯互为同系物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某有机物A的结构简式为:
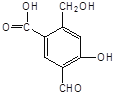
(1)A与过量的NaOH溶液反应时,A与参加反应的NaOH的物质的量之比是____________。
(2)A与新制Cu(OH)2反应时,A与被还原的Cu(OH)2的物质的量之比是___________。1molA最多能消耗____________mol Cu(OH)2。
(3)A与过量的NaHCO3反应时,A与NaHCO3的物质的量之比是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以0.10mol/L的氢氧化钠溶液滴定同浓度某一元酸HA的滴定曲线如图所示(![]() )。下列表述错误的是( )
)。下列表述错误的是( )
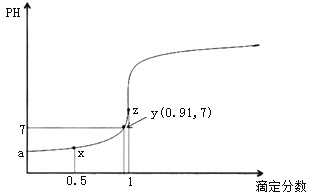
A.z点后存在某点,溶液中的水的电离程度和y点的相同
B.a约为3.5
C.z点处,![]()
D.x点处的溶液中离子满足:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲醇(CH3OH)是一种绿色能源。如图所示,某同学设计一个甲醇燃料电池并探究氯碱工业原理和粗铜的精炼原理,其中乙装置中X为阳离子交换膜.
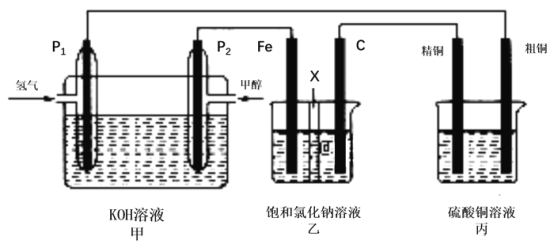
根据要求回答相关问题:
(1)写出负极的电极反应式____________,甲装置中碱性_____(填增强、减弱或不变)
(2)铁电极为______(填“阳极”或“阴极” ),石墨电极(C)的电极反应式为______。
(3)若将乙装置中两电极位置互换,其他装置不变,乙装置中发生的总反应式______ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,将0.10 mol·L-1盐酸逐滴滴入20.00 mL 0.10 mol·L-1氨水中,溶液中pH和pOH随加入盐酸体积变化曲线如图所示。已知:pOH= -lg c(OH-)。下列说法正确的是( )
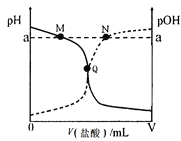
A. M点所示溶液中:c(NH4+)+c(NH3·H2O)= c(Cl-)
B. N点所示溶液中:c(NH4+)>c(Cl-)
C. Q点所示消耗盐酸的体积等于氨水的体积
D. M点和N点所示溶液中水的离子积相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化铁水解的离子方程式为______________,其溶液中离子浓度大小顺序为_____________。现向氯化铁溶液中加入碳酸钙粉末,发现碳酸钙逐渐溶解,并产生无色气体,其反应的离子方程式为:__________________。同时有红褐色沉淀生成,其原因是____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知常温下某二元酸发生如下电离:H2A=H++HA-;HA-![]() H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
H++A2-(Ka=1×10﹣2)。则下列说法中正确的是( )
A. NaHA溶液呈酸性,因为HA-的电离程度大于水解程度
B. 常温下pH=10的Na2A溶液中c(A2-)是c(HA-)的108倍
C. 常温下pH=2的H2A溶液中c(A2-)小于c(HA-)
D. 0.1mol/LH2A溶液中c(A2-)+c(HA-)+c(H2A)=0.1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO、CO2的回收对减少碳的排放、改善生态环境和构建生态文明具有重要的意义。回答下列问题:
(1)已知:①CO(g)+2H2(g)![]() CH3OH(g) ΔH=99 kJ·mol1
CH3OH(g) ΔH=99 kJ·mol1
②CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH=+41 kJ·mol1
CO(g)+H2O(g) ΔH=+41 kJ·mol1
则反应CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH=_________。
CH3OH(g)+H2O(g) ΔH=_________。
(2)向容积相同的三个恒容密闭容器中分别通入一定量H2、CO,控制适当条件使其发生反应:2H2(g)+CO(g)![]() CH3OH(g),反应中有关数据如下表所示:
CH3OH(g),反应中有关数据如下表所示:
容器 | 温度/K | 物质的起始浓度/mol/L | 物质的平衡浓度/mol/L | |
c(H2) | c(CO) | c(CH3OH) | ||
A | 350 | 0.40 | 0.20 | 0.16 |
B | 350 | 0.80 | 0.40 | |
C | T | 0.40 | 0.20 | 0.05 |
反应从开始到达到平衡时,平均反应速率:容器A____容器C(填“>”或“<”,后同),容器B中CO的转化率____80%。
(3)①CO2和H2在一定条件下能发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
C2H4(g)+4H2O(g) ΔH<0。向一恒压密闭容器中入1 mol CO2 和3 mol H2,容器中H2的平衡转化率α随温度、压强的变化如图所示。
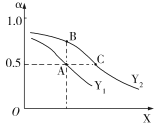
X表示___(填“温度”或“压强”),状态A、B、C对应的平衡常数K(A)、K(B)、K(C)的相对大小顺序为_____。
②向M、N两个初始容积相同的密闭容器中各充入2 mol CO2 和6 mol H2,控制适当条件使其发生如下反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
C2H4(g)+4H2O(g)ΔH<0。其中M为恒压容器,N为恒容容器,若维持两容器的温度相同,则平衡时混合气体平均相对分子质量较大的是______(填“M”或“N”)。
(4)用NaOH溶液做碳捕捉剂,在降低碳排放的同时也获得了重要的化工产品Na2CO3。常温下,若某次捕捉后得到pH=10的溶液,则溶液中c(![]() )∶c(
)∶c(![]() )=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(
)=___________[K1(H2CO3)=4.4×107、K2(H2CO3)=5×1011],溶液中c(Na+)_______ c(![]() )+2c(
)+2c(![]() )(填“>”“<”或“=”)。
)(填“>”“<”或“=”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com