
°æƒø°øº◊¥º£®CH3OH£© «“ª÷÷¬Ã…´ƒÐ‘¥°£»ÁÕºÀ˘ 棨ƒ≥Õ¨—߅˺∆“ª∏ˆº◊¥º»º¡œµÁ≥ÿ≤¢ÃΩæø¬»ºÓ𧓵‘≠¿Ì∫Õ¥÷Õ≠µƒæ´¡∂‘≠¿Ì£¨∆‰÷–““◊∞÷√÷–XŒ™—Ù¿Î◊”Ωªªªƒ§£Æ
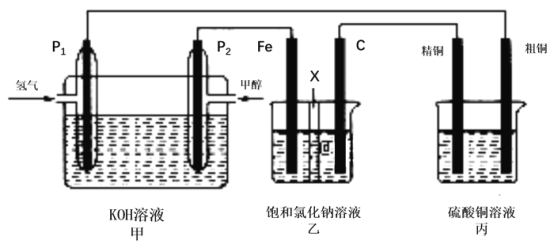
∏˘æð“™«Ûªÿ¥œýπÿŒ £∫
£®1£©–¥≥ˆ∏∫º´µƒµÁº´∑¥”¶ Ω____________£¨º◊◊∞÷√÷–ºÓ–‘_____£®ÃÓ‘ˆ«ø°¢ºı»ıªÚ≤ª±‰£©
£®2£©Ã˙µÁº´Œ™______£®ÃÓ°∞—Ùº´°±ªÚ°∞“ıº´°± £©£¨ ؃´µÁº´£®C£©µƒµÁº´∑¥”¶ ΩŒ™______°£
£®3£©»ÙΩ´““◊∞÷√÷–¡ΩµÁº´Œª÷√ª•ªª£¨∆‰À˚◊∞÷√≤ª±‰£¨““◊∞÷√÷–∑¢…˙µƒ◊Ð∑¥”¶ Ω______ °£
°æ¥∞∏°øCH3OH+8OH--6e-£ΩCO32-+6H2O ºı»ı “ıº´ 2Cl--2e-=Cl2°¸ Fe+2H2O![]() Fe(OH)2 +H2°¸
Fe(OH)2 +H2°¸
°æΩ‚Œˆ°ø
¥”Õº÷–ø…“‘ø¥≥ˆ£¨º◊≥ÿŒ™‘≠µÁ≥ÿ(◊˜µÁ‘¥)£¨““≥ÿŒ™µÁΩ‚≥ÿ£¨±˚≥ÿŒ™Õ≠µƒµÁΩ‚æ´¡∂°£º◊≥ÿ÷–£¨Õ®º◊¥ºµƒµÁº´Œ™∏∫º´£¨Õ®—ı∆¯µƒµÁº´Œ™’˝º´£ª““≥ÿ÷–£¨FeµÁº´Œ™“ıº´£¨CµÁº´Œ™—Ùº´£ª±˚≥ÿ÷–£¨æ´Õ≠Œ™“ıº´£¨¥÷Õ≠Œ™—Ùº´°£
£®1£©Õ®»Î∏∫º´…œº◊¥º»º¡œ ßµÁ◊”∫Õ«‚—ı∏˘¿Î◊”∑¢…˙—ıªØ∑¥”¶…˙≥…ÀÆ£¨µÁº´∑¥”¶ ΩŒ™CH3OH+8OH--6e-£ΩCO32-+6H2O£¨’˝º´∑¥”¶∑Ω≥Ã ΩŒ™£∫O2+2H2O+4e-=4OH-£¨”…”⁄‘⁄∑¥”¶÷–”–ÀÆ…˙≥…£¨“Ú¥À«‚—ıªØºÿ»Ð“∫µƒ≈®∂»ΩµµÕ£¨pHΩµµÕ£¨π ¥∞∏Œ™£∫CH3OH+8OH--6e-£ΩCO32-+6H2O£¨ºı»ı£ª
£®2£©Ã˙µÁº´¡¨Ω”‘≠µÁ≥ÿ∏∫º´∂¯◊˜µÁΩ‚≥ÿ“ıº´£¨Ãº◊˜—Ùº´£¨µÁΩ‚¬»ªØƒ∆±•∫ջГ∫ ±£¨—Ùº´…œ¬»¿Î◊”∑≈µÁ£¨µÁº´∑¥”¶ ΩŒ™2Cl--2e-=Cl2°¸£¨π ¥∞∏Œ™£∫“ıº´£ª2Cl--2e-=Cl2°¸£ª
£®3£©»ÙΩ´““◊∞÷√÷–¡ΩµÁº´Œª÷√ª•ªª£¨—Ùº´Œ™Ã˙£¨Ã˙ ßµÁ◊”£ª“ıº´«‚¿Î◊”µ√µÁ◊”£ªµÁº´∑¥”¶ ΩFe+2H2O![]() Fe(OH)2 +H2°¸£¨π ¥∞∏Œ™£∫Fe+2H2O
Fe(OH)2 +H2°¸£¨π ¥∞∏Œ™£∫Fe+2H2O![]() Fe(OH)2 +H2°¸
Fe(OH)2 +H2°¸


 Õ¨≤ΩÕÿ’π‘ƒ∂¡œµ¡–¥∞∏
Õ¨≤ΩÕÿ’π‘ƒ∂¡œµ¡–¥∞∏
| ƒÍº∂ | ∏þ÷–øŒ≥à | ƒÍº∂ | ≥ı÷–øŒ≥à |
| ∏þ“ª | ∏þ“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı“ª | ≥ı“ª√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ∂˛ | ∏þ∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı∂˛ | ≥ı∂˛√‚∑—øŒ≥ÃÕ∆ºˆ£° |
| ∏þ»˝ | ∏þ»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° | ≥ı»˝ | ≥ı»˝√‚∑—øŒ≥ÃÕ∆ºˆ£° |
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒÐ’˝»∑±Ì 本¡–∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ωµƒ «£® £©
A.”√π˝¡ø∞±ÀÆŒ¸ ’𧓵Œ≤∆¯÷–µƒSO2£∫2NH3°§H2O£´SO2=2NH4+£´SO32-£´H2O
B.Ca(HCO3)2»Ð“∫”Î…Ÿ¡øNaOH»Ð“∫∑¥”¶£∫Ca2£´£´2HCO3-£´2OH£≠=CaCO3°˝£´CO32-£´2H2O
C.¥≈–‘—ıªØÃ˙»Ð”⁄◊„¡øœ°œıÀ·£∫ Fe3O4£´8H£´=Fe2£´£´2Fe3£´£´4H2O
D.√˜∑ػГ∫÷–µŒ»ÎBa(OH)2»Ð“∫ πSO42-«°∫√ÕÍ»´≥¡µÌ£∫2Ba2£´£´3OH£≠£´Al3£´£´2SO42-=2BaSO4°˝£´Al(OH)3°˝
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø≥£Œ¬œ¬£¨ Ω´œ° HCl»Ð“∫µŒº”µΩµ»≈®∂»µƒ»ıºÓ AOH»Ð“∫÷–£¨ ≤‚µ√ªÏ∫œ“∫µƒ pH∫Õlg[C(AOH)/C(A+)] µƒπÿœµ»ÁÕºÀ˘ 棨 ∆‰÷– aµ„±Ì 挥º”—ŒÀ· ±µƒ ˝æ𣨠eµ„±Ì æ HCl∫Õ AOH«°∫√ÕÍ»´∑¥”¶ ±µƒ ˝æ𰣜¬¡–Àµ∑®¥ÌŒÛµƒ «

A. ≥£Œ¬œ¬£¨ A+µƒÀÆΩ‚∆Ω∫‚≥£ ˝Œ™ 1.0°¡10£≠10
B. µ„e»Ð“∫÷–ÀƵÁ¿Î≥ˆµƒH+≈®∂»Œ™ 10£≠6.23mol/L
C. µ„c »Ð“∫÷–µƒ n(A+)+n(AOH)µ»”⁄µ„ e»Ð“∫÷–µƒ n(Cl£≠)
D. µ„d»Ð“∫÷–£∫ c(Cl£≠)> c(AOH)>c(A+)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø£®æŸ“ª∑¥»˝£©A°¢B°¢C°¢Dæ˘Œ™÷–—ߪؗß≥£º˚µƒ¥ø檌ԣ¨A «µ•÷ °£À¸√«÷ƺ‰”–»Áœ¬µƒ∑¥”¶πÿœµ£∫

(1)»ÙA «µ≠ª∆…´πÃã¨C°¢D «—ıªØŒÔ£¨C «‘Ï≥…À·”͵ƒ÷˜“™ŒÔ÷ £¨µ´C“≤”–∆‰π„∑∫µƒ”√Õ棨–¥≥ˆ∆‰÷–µƒ¡Ω∏ˆ”√Õæ£∫_____________________________°£
(2)»ÙB «∆¯Ã¨«‚ªØŒÔ£¨C°¢D «—ıªØŒÔ«“ª·‘Ï≥…π‚ªØ—ߗÌ̌€»æ°£B”ÎC‘⁄“ª∂®Ãıº˛œ¬∑¥”¶…˙≥…µƒA «¥Û∆¯µƒ÷˜“™≥…∑÷£¨–¥≥ˆ∏√∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫_____________________________°£
(3)»ÙDŒÔ÷ æþ”–¡Ω–‘£¨¢⁄°¢¢€∑¥”¶æ˘“™”√«øºÓ»Ð“∫£¨¢Ð∑¥”¶ ±Õ®»Îπ˝¡øµƒ“ª÷÷“˝∆Œ¬ “–ß”¶µƒ÷˜“™∆¯Ã°£≈–∂œµ•÷ Aµƒ‘™Àÿ‘⁄÷Ð∆⁄±Ì÷–µƒŒª÷√£∫___________________________°£
(4)»ÙA «Ã´—كеÁ≥ÿ”√µƒπ‚∑¸≤ƒ¡œ°£C°¢DŒ™ƒ∆—Œ£¨¡Ω÷÷ŒÔ÷ ÷–≥˝ƒ∆°¢—ıÕ‚µƒ‘™ÀÿŒ™Õ¨“ª÷˜◊£¨«“»Ð“∫æ˘œ‘ºÓ–‘°£–¥≥ˆ¢⁄∑¥”¶µƒªØ—ß∑Ω≥Ã Ω£∫_______________________________°£
DµƒªØ—ß Ω «________°£
(5)»ÙA «”¶”√◊Óπ„∑∫µƒΩ Ù°£¢Ð∑¥”¶”√µΩA£¨¢⁄°¢¢ð∑¥”¶æ˘”√µΩÕ¨“ª÷÷∑«Ω Ùµ•÷ °£Cµƒ»Ð“∫”√”⁄ ¥øÔ°À¢Õ≠µÁ¬∑∞£¨–¥≥ˆ∏√∑¥”¶µƒ¿Î◊”∑Ω≥Ã Ω£∫_________________________ °£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø≥£Œ¬œ¬£¨Ω´0.2000mol/LµƒNaOH»Ð“∫÷µŒº”»ÎµΩ20.00mL0.2000mol/LNH4Cl»Ð“∫÷–£¨»Ð“∫µƒpH”ÎÀ˘º”NaOH»Ð“∫µƒÃª˝µƒπÿœµ»ÁÕºÀ˘ æ(≤ªøº¬«ª”∑¢)°£œ¬¡–Àµ∑®¥ÌŒÛµƒ «£® £©

A.aµ„»Ð“∫÷–£∫c(NH3H2O)+c(H+)=c(OH-)+c(NH4+)
B.¥”aµ„µΩdµ„ÀƵƒµÁ¿Î≥Ã∂»≤ª∂œºı»ı
C.bµ„»Ð“∫÷–£∫c(Cl-)>c(Na+)>c(H+)=c(OH-)
D.cµ„»Ð“∫÷–£∫c(NH3H2O)+c(NH4+)=2c(Na+)
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø‘⁄“ª∂®Œ¬∂»œ¬£¨ø…ƒÊ∑¥”¶X(g)+3Y(g)![]() 2Z(g)¥ÔµΩ∆Ω∫‚µƒ±Í÷æ «
2Z(g)¥ÔµΩ∆Ω∫‚µƒ±Í÷æ «
¢ŸZ…˙≥…µƒÀŸ¬ ”ÎZ∑÷Ω‚µƒÀŸ¬ œýµ» ¢⁄µ•Œª ±º‰…˙≥…a mol X£¨Õ¨ ±…˙≥…3a mol Y
¢€X°¢Y°¢Zµƒ≈®∂»≤ª‘Ÿ±‰ªØ ¢ÐX°¢Y°¢Zµƒ∑÷◊” ˝±»Œ™1£∫3£∫2
¢ðX°¢Y°¢Zµƒ≈®∂»œýµ» ¢ÞX°¢Y°¢Zµƒ÷ ¡ø≤ª‘Ÿ∑¢…˙±‰ªØ
A.¢Ÿ¢€¢ÞB.¢Ÿ¢⁄¢€C.¢Ÿ¢⁄¢ð¢ÞD.¢Ÿ¢⁄¢€¢Ð¢ð¢Þ
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø≤ðÀ·(H2C2O4) «“ª÷÷∂˛‘™»ıÀ·°£≥£Œ¬œ¬œÚH2C2O4»Ð“∫÷–µŒº”NaOH»Ð“∫£¨ªÏ∫œ»Ð“∫¿ÔlgX[X±Ì æ![]() ªÚ
ªÚ![]() ]ÀÊpHµƒ±‰ªØπÿœµ»ÁÕºÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «
]ÀÊpHµƒ±‰ªØπÿœµ»ÁÕºÀ˘ æ°£œ¬¡–Àµ∑®≤ª’˝»∑µƒ «

A. ÷±œþI÷–X±Ì 浃 «![]()
B. ÷±œþI°¢¢Úµƒ–±¬ æ˘Œ™1
C. c(HC2O4£≠)>c(C2O42£≠)>c(H2C2O4)∂‘”¶1.22<pH<4.19
D. c(Na+)=c(HC2O4£≠)+2c(C2O42£≠)∂‘”¶pH=7
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°ø∞±ø…”√”⁄÷∆»°∞±ÀÆ°¢µ™∑ °¢œıÀ·°¢Ôß—Œ°¢¥øºÓµ»£¨“Ú¥À±ªπ„∑∫”¶”√”⁄ªØπ§°¢«·π§°¢ªØ∑ °¢÷∆“©°¢∫œ≥…œÀŒ¨°¢ÀСœµ»––“µ£Æ
£®1£©“‘º◊ÕÈŒ™‘≠¡œø…÷∆µ√∫œ≥…∞±”√µƒ«‚∆¯£¨”–πÿ∑¥”¶µƒƒÐ¡ø±‰ªØ»Áœ¬ÕºÀ˘ æ£∫
 °°
°°

–¥≥ˆCH4(g)”ÎH2O(g)∑¥”¶…˙≥…CO(g)∫ÕH2(g)µƒ»»ªØ—ß∑Ω≥Ã Ω£∫_______________°£
£®2£©“—÷™N2(g)£´3H2(g)![]() 2NH3(g)£ª°˜H= -94.4kJ°§mol-1£¨‘⁄ƒ≥»ðª˝Œ™2Lµƒ∫„»ð»ð∆˜÷–∑¢…˙∫œ≥…∞±∑¥”¶£¨ÃÂœµ÷–∏˜ŒÔ÷ ≈®∂»ÀÊ ±º‰±‰ªØµƒ«˙œþ»ÁÕºÀ˘ æ£∫
2NH3(g)£ª°˜H= -94.4kJ°§mol-1£¨‘⁄ƒ≥»ðª˝Œ™2Lµƒ∫„»ð»ð∆˜÷–∑¢…˙∫œ≥…∞±∑¥”¶£¨ÃÂœµ÷–∏˜ŒÔ÷ ≈®∂»ÀÊ ±º‰±‰ªØµƒ«˙œþ»ÁÕºÀ˘ æ£∫

¢Ÿ«∞20minƒ⁄v(NH3)=________mol/(L°§min)£¨∑≈≥ˆµƒ»»¡øŒ™________°£
¢⁄45min ±≤…»°µƒ¥Î © «________£ª ±∂ŒIIIÃıº˛œ¬∑¥”¶µƒ∆Ω∫‚≥£ ˝Œ™________£®±£¡Ù3Œª”––ß ˝◊÷£©°£
£®3£©“ª∂®Œ¬∂»œ¬£¨Ω´≤ªÕ¨¡øµƒCO2°¢NH3∑÷±Õ®»Îƒ≥∫„»ð√б’»ð∆˜÷–Ω¯––œ¬¡–∑¥”¶£∫2NH3(g)+CO2(g)=CO(NH2)2(l)+H2O(g)£ª°˜H£º0£¨µ√µΩ»Áœ¬ ˝æð£∫
µ—È◊È | ∆ º¡ø/mol | ∆Ω∫‚ ±µƒ◊™ªØ¬ | ∆Ω∫‚ ±∆¯ÃÂ∆Ωæ˘œý∂‘∑÷◊”÷ ¡ø | ||
NH3(g) | CO2(g) | NH3(g) | CO2(g) | ||
1 | 2 | 1 | a1 | a2 | M1 |
2 | 4 | 2 | a3 | a4 | M2 |
3 | n1 | n2 | a5 | a6 | M3 |
¢Ÿa1________a4£®ÃÓ°∞£º°±°¢°∞£Ω°±ªÚ°∞£æ°±£©£ªM1________ M2£®ÃÓ°∞£º°±°¢°∞£Ω°±ªÚ°∞£æ°±£©°£
¢⁄»Ùa5>a6£¨‘Ún1£¨n2±ÿ–ά˙◊„µƒπÿœµ «________°£
£®4£© “Œ¬ ±Ω´∞±Õ®»Î500mL 0.1mol°§L-1—ŒÀ·÷–÷¡pH=6£¨À˘µ√»Ð“∫÷–¿Î◊”≈®∂»”…¥ÛµΩ–°µƒÀ≥–Ú «____________________________________________°£
£®5£©∞±°¢ø’∆¯°¢KOH»Ð“∫ø…ππ≥…»º¡œµÁ≥ÿ£¨∑¥”¶‘≠¿ÌŒ™4NH3+3O2=2N2+6H2O£¨∑¥”¶“ª∂Œ ±º‰∫Û£¨µÁΩ‚÷ »Ð“∫µƒpHΩ´________£®ÃÓ°∞‘ˆ¥Û°±°∞ºı–°°±ªÚ°∞≤ª±‰°±£©°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
ø∆ƒø£∫∏þ÷–ªØ—ß ¿¥‘¥£∫ –գ∫
°æƒø°øƒø«∞𧓵…œø…¿˚”√COªÚCO2¿¥…˙≤˙»º¡œº◊¥º£¨ƒ≥—–æø–°◊È∂‘œ¬¡–”–πÿº◊¥º÷∆»°µƒ»˝ÃıªØ—ß∑¥”¶‘≠¿ÌΩ¯––ÃΩæø°£“—÷™‘⁄≤ªÕ¨Œ¬∂»œ¬µƒªØ—ß∑¥”¶∆Ω∫‚≥£ ˝(K1°¢K2°¢K3)»Áœ¬±ÌÀ˘ æ£∫
ªØ—ß∑¥”¶ | Ï ±‰ | ∆Ω∫‚≥£ ˝ | Œ¬∂»/°Ê | ||
500 | 700 | 800 | |||
¢Ÿ2H2(g)£´CO(g) | ¶§H1 | K1 | 2.5 | 0.34 | 0.15 |
¢⁄CO2(g)£´H2(g) | ¶§H2 | K2 | 1.0 | 1.70 | 2.52 |
¢€CO2(g)£´3H2(g) | ¶§H3 | K3 | |||
«Îªÿ¥œ¬¡–Œ £∫
(1)∑¥”¶¢⁄ «________(ÃÓ°∞Œ¸»»°±ªÚ°∞∑≈»»°±)∑¥”¶°£
(2)∏˘æð∑¥”¶¢Ÿ”΢⁄ø…Õ∆µº≥ˆK1°¢K2”ÎK3÷ƺ‰µƒπÿœµ£¨‘ÚK3£Ω________(”√K1°¢K2±Ì æ)£ª∏˘æð∑¥”¶¢€≈–∂œ¶§S___0(ÃÓ°∞>°±°¢°∞£Ω°±ªÚ°∞<°±)£¨‘⁄______(ÃÓ°∞Ωœ∏þ°±ªÚ°∞ΩœµÕ°±)Œ¬∂»œ¬”–¿˚”⁄∏√∑¥”¶◊‘∑¢Ω¯––°£
(3)500°Ê ±£¨≤‚µ√∑¥”¶¢€‘⁄ƒ≥ ±øã¨CO2(g)°¢H2(g)°¢CH3OH(g)°¢H2O(g)µƒ≈®∂»∑÷±Œ™0.1mol/L°¢0.8mol/L°¢0.3mo/L°¢0.15mol/L£¨‘Ú¥À ±v’˝________vƒÊ(ÃÓ°∞>°±°¢°∞£Ω°±ªÚ°∞<°±)°£
≤Èø¥¥∞∏∫ÕΩ‚Œˆ>>
π˙º —ß–£”≈—° - ¡∑œ∞≤·¡–±Ì - ‘¡–±Ì
∫˛±± °ª•¡™Õ¯Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®∆Ωî | Õ¯…œ”–∫¶–≈œ¢æŸ±®◊®«¯ | µÁ–≈’©∆≠柱®◊®«¯ | …Ê¿˙ ∑–ÈŒÞ÷˜“”–∫¶–≈œ¢æŸ±®◊®«¯ | …Ê∆Û«÷»®æŸ±®◊®«¯
Œ•∑®∫Õ≤ª¡º–≈œ¢æŸ±®µÁª∞£∫027-86699610 柱®” œ‰£∫58377363@163.com