
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )

A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
 100分闯关期末冲刺系列答案
100分闯关期末冲刺系列答案科目:高中化学 来源: 题型:
【题目】下列说法中正确的是
A. 电解NaCl溶液、熔融态的氯化镁可制得相应的金属单质
B. 工业上可用含Cu2S的矿石和氧化剂O2反应冶炼Cu
C. 铝热反应可用于冶炼高熔点金属,如K、Ca、Cr、Mn等
D. 工业电解熔融态的Al2O3制Al时,加冰晶石的主要作用是提高Al的产量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是( )
A. 标准状况下,22.4L H2O含有的分子数为1 NA
B. 常温常压下,1.06g Na2CO3含有的Na+离子数为0.02 NA
C. 常温常压下,1 NA 个CO2分子占有的体积为22.4L
D. 物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl- 个数为1 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)0.5 mol的Fe含___________个铁原子(用6.02×1023表示阿伏加德罗常数),质量是_______g;
(2)2mol CO2中含______ mol碳原子__________个氧原子(以NA为阿伏加德罗常数的值),________个质子(以NA为阿伏加德罗常数的值),标准状况下的体积为___________L,质量是______________g。
(3)在标准状况下,体积为8.96 L的CO和CO2的混合气体共14.4 g,
①CO的质量为________
②混合气体的平均摩尔质量为________
③CO2的体积为________
④混合气体的密度为_____(小数点后保留1位)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 断裂化学键会释放能量
B. 物质的内能与其聚集状态有关
C. 放热反应均无需加热就能发生
D. 根据能量守恒定律,反应物的总能量等于生成物的总能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84g/cm3)配制100mL 1.0mol·L1稀硫酸,若实验仪器有:
A.100mL量筒 B.托盘天平 C.玻璃棒 D.50mL容量瓶 E.10mL量筒 F.50mL烧杯 G.100mL容量瓶
(1)完成该实验还缺少的仪器是______。
(2)本实验需量取浓硫酸的体积为___mL。
(3)在容量瓶使用方法中,下列操作不正确的是_____(填序号)。
A.使用容量瓶前检查它是否漏水
B.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
C.将确量取的18.4mol·L1的硫酸,注入已盛有30mL水的100mL的容量瓶中,加水至刻度线
D.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
(4)下列情况使所配制的稀硫酸浓度偏大是_____ (填序号)。
A.所用的浓硫酸长时间放置在密封不好的容器中
B.容量瓶用蒸馏水洗涤后残留有少量的水
C.定容时俯视溶液的凹液面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】NH4Fe(SO4)2·12H2O被称为“铁铵矾”,广泛用于城镇生活用水、工业循环水的净化处理。某同学称取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
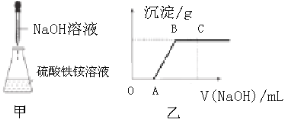
请回答下列问题。
(1)溶解NH4Fe(SO4)2·12H2O固体所用的玻璃仪器有___(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______。
(3)AB段反应的离子方程式为______。
(4)BC段反应的离子方程式为______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上利用可逆反应N2(g)+3H2(g) ![]() 2NH3(g)合成氨,下列叙述正确的是( )
2NH3(g)合成氨,下列叙述正确的是( )
A.合成氨的适宜条件是高温高压催化剂,其中催化剂不改变该反应的逆反应速率
B.恒容通入氩气,使反应体系的压强增大,反应速率一定增大
C.该反应是放热反应,降低温度将缩短反应达到平衡的时间
D.在t1、t2时刻,NH3 (g)的浓度分别是c1、c2,则时间间隔t1~t2内,NH3 (g)生成的平均速率为v=![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】天然气是一种清洁能源,用途广泛。
(1)工业上可用焦炉煤气(主要成分为CO、CO2和H2)制备天然气。已知:CO(g)+3H2(g)=CH4(g) +H2O(g) △H1=-206kJ/mol,CO(g)+H2O(g)=H2(g)+CO2(g) △H2= -41kJ/mol。
①CO2转化为CH4的热化学方程式是:_______。
②有利于提高混合气中CH4含量的措施是:_______。
a. 使用催化剂 b. 升高温度 c. 及时导出水蒸气
(2)甲烷可制成燃料电池,其装置如下图所示。

①电极b是_______极(填“正”或“负”)。
②a极的电极反应式是_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com