
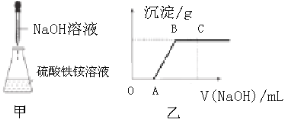
【题目】NH4Fe(SO4)2·12H2O被称为“铁铵矾”,广泛用于城镇生活用水、工业循环水的净化处理。某同学称取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,然后向此混合溶液中逐滴加入NaOH溶液(如图甲所示)。滴加过程中产生沉淀的质量与加入NaOH溶液的体积的关系如图乙所示。
请回答下列问题。
(1)溶解NH4Fe(SO4)2·12H2O固体所用的玻璃仪器有___(填字母)。
a.天平 b.烧杯 c.漏斗 d.玻璃棒
(2)OA段反应的离子方程式为______。
(3)AB段反应的离子方程式为______。
(4)BC段反应的离子方程式为______。
【答案】bd H++OH-=H2O Fe3++3OH-=Fe(OH)3↓ NH4++OH-=NH3·H2O
【解析】
取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,得到含有NH4Fe(SO4)2和硫酸的混合溶液,在该混合溶液中逐滴加入NaOH溶液,根据图像,首先发生酸碱中和反应,没有沉淀生成;然后沉淀逐渐增多,说明发生的是铁离子的沉淀反应,随后沉淀不变,说明发生的是铵根离子的反应,据此分析解答。
(1)溶解NH4Fe(SO4)2·12H2O固体需要使用的玻璃仪器有烧杯和玻璃棒,故答案为:bd;
(2)取一定质量的NH4Fe(SO4)2·12H2O固体溶于一定量的稀硫酸中,然后向此混合溶液[NH4Fe(SO4)2和硫酸]中逐滴加入NaOH溶液,根据图像,OA段没有沉淀生成,发生的反应是NaOH和硫酸的反应,所以OA段反应的离子方程式为:H++OH-═H2O,故答案为:H++OH-═H2O;
(3)硫酸反应完后,沉淀逐渐增多,曲线中对应B点之后,沉淀质量不再改变,所以AB段反应的离子方程式为:Fe3++3OH-=Fe(OH)3↓,故答案为:Fe3++3OH-=Fe(OH)3↓;
(4)根据(3)的分析,BC段反应的离子方程式为NH4++OH-=NH3·H2O,故答案为:NH4++OH-=NH3·H2O。


 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】对可逆反应4NH3(g) + 5O2(g) ![]() 4NO(g) + 6H2O(g),下列叙述正确的是
4NO(g) + 6H2O(g),下列叙述正确的是
A. 化学反应速率关系是:2v正(NH3) = 3v正(H2O)
B. .若单位时间内生成x mol NO的同时,消耗x mol NH3,则反应达到平衡状态
C. 达到化学平衡时,若增加容器体积,则正反应速率减小,逆反应速率增大
D. 达到化学平衡时,4v正(O2) = 5v逆(NO)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25 ℃时,在20 mL 0.1 mol·L-1NaOH溶液中逐滴加入0.2 mol·L-1醋酸溶液,曲线如图所示,有关粒子浓度关系的比较中,不正确的是( )

A. 在A点:c(Na+)>c(OH-)>c(CH3COO-)>c(H+)
B. 在B点:c(OH-)=c(H+),c(Na+)=c(CH3COO-)
C. 在C点:c(CH3COO-)>c(Na+)>c(H+)>c(OH-)
D. 在C点:c(CH3COO-)+c(CH3COOH)=2c(Na+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与安全事故的处理中错误的是( )
A. 使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B. 用试管夹从试管底部由下往上夹住距试管口约![]() 处,手持试管夹长柄末端,进行加热
处,手持试管夹长柄末端,进行加热
C. 点燃酒精灯前一定要将酒精添满
D. 把玻璃管插入橡皮塞口时,用厚布护手,紧握用水湿润的玻璃管插入端,缓慢旋进孔中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知0.5L的NaCl溶液中含有0.5molNa+。下列关于该溶液的说法不正确的是( )
A. 该溶液中溶质的物质的量浓度为1 mol·L-1
B. 该溶液中含有58.5gNaCl
C. 配制1000mL该溶液需用58.5gNaCl
D. 量取100mL该溶液倒入烧杯中,烧杯中Na+的物质的量为0.1mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA表示阿伏加德罗常数,下列叙述中正确的是( )
A. 常温常压下,11.2LCO2所含的原子数为1.5NA
B. 常温常压下,48gO3所含的原子数为3NA
C. 标准状况下,22.4LH2O所含的分子数为NA
D. 22.4LH2所含的原子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO和NO都是汽车尾气中的有害物质,它们之间能缓慢地发生如下反应:2NO(g)+2CO(g) ![]() N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
N2(g)+2CO2(g) ΔH<0,现利用此反应,拟设计一种环保装置,用来消除汽车尾气对大气的污染,下列方案可以提高尾气处理效率的是( )
①选用适当的催化剂 ②提高装置温度 ③增大装置的压强 ④装置中放入碱石灰
A. ①③④ B. ①②③ C. ②③④ D. ①②③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚合物( )是良好的生物可降解材料,其合成路线如下:
)是良好的生物可降解材料,其合成路线如下:

已知: (R,R’,R’’代表烷基或H)
(R,R’,R’’代表烷基或H)
(1)已知A的核磁共振氢谱有二个峰,A的结构简式是_______。
(2)B可使澄清的苯酚钠水溶液变浑浊,B中的含氧官能团名称是________。
(3)B与试剂a在一定条件下反应生成C的化学方程式是________。
(4)D转化为E的化学方程式是________。
(5)F的结构简式是________。
(6)由G生成H的化学方程式是________。
(7)聚合物P具有较好的可降解性,其原因是_________。
(8)以1,3-丁二烯为原料(无机试剂任选),设计J的合成路线________。合成路线流程图示例如下:
![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com