
【题目】氮的固定对工农业及人类生存具有重大意义。
Ⅰ.合成氨是最重要的人工固氮:N2(g)+3H2(g)![]() 2NH3(g)。
2NH3(g)。
(1)下列关于该反应的说法中,正确的是 。
A.△H>0,△S>0 B.△H>0,△S<0
C.△H<0,△S>0 D.△H<0,△S<0
(2) —定温度下,在容积为1L的密闭容器中,加入ImolN2和3molH2,反应达到平衡时H2的转化率为60%,则此条件下反应的平衡常数K= (此处不要求写单位);保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,氢气的转化率将 (填“增大”、“减小”或“不变”)
(3)标准状况下,若将22.4mL的氨气通入100mLpH为2的盐酸中.则溶液中各离子浓度的顺序由大到小为 。
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入适量的CO2气体,充分反应后,过滤所得滤液为(NH4)2SO4溶液,该过程的化学方程式为 。
II.随着研究的不断深入,科学家发明了越來越多有关氮的固定方法。
(5)20世纪末,科学家采用高质子导电性的SCY陶瓷(能传递H+)为介质,用吸附在它内外表面上的金属钯多晶薄膜做电极,实现常压、570℃高温的电解法合成氨,提高了反应物的转化率,其实验简图如下,阴极的电极反应式为 。

(6)近年,又有科学家提出在常温、常压、催化剂等条件下合成氨气的新思路,反应原理为:
2N2(g)+6H2O(I) ![]() 4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g)
4NH3(g)+3O2(g),则其反应热△H= 。(已知:N2(g)+3H2(g) ![]() 2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g)
2NH3(g) △H=-92.4kJ·mol-1;2H2(g)+O2(g) ![]() 2H2O(I) △H=-571.6kJ·mol-1)
2H2O(I) △H=-571.6kJ·mol-1)
【答案】(1)D (2分)(2))25/12 (或2.08) (2分);增大(2分)
(3)c(Cl-)>c(NH4+)>c(H+)>c(OH-) (2分)
(4)CaSO4+CO2+2NH3+H2O=CaCO3↓+(NH4)2SO4 (2 分)
(5)N2+6e-+6H+ = 2NH3 (2 分)(6)+1530.0kJ·mol-1 (2分)
【解析】
试题分析:(1)B.此反应为放热反应,且向体积减小的方向进行,△H>0,且是熵境故D正确;A.△S>0,故A正确;(2)1molNH3和10-3molHCl反应生成NH4Cl,溶液中氯化铵物质的量为10-3mol,一水合氨物质的量1-0.001=0.999mol;所以溶液中离子浓度大小为:c(NH4+)>c(OH-)>c(Cl-)>c(H+);
(2)K=![]() =25/12; 保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,平衡向正方向进行,氢气的转化率将增大;
=25/12; 保持容器体积不变,再向容器中加入lmolN2,3molH2反应达到平衡时,平衡向正方向进行,氢气的转化率将增大;
(3)1molNH3和10-3molHCl反应生成NH4Cl,溶液中氯化铵物质的量为10-3mol,一水合氨物质的量
(4)将氨气通入盛有CaSO4悬浊液的沉淀池中,再通入足量的CO2,过滤后即可得到(NH4)2SO4.沉淀为CaCO3,说明CaCO3更难溶,CaSO4与CaCO3的构成类型相同为AB型,相同类型溶解度越小,溶度积越小,故Ksp(CaSO4)>Ksp(CaCO3),该过程的化学方程式为:CaSO4+2NH3+CO2+H2O=CaCO3↓+(NH4)2SO4;
(5)电解池中氮气在阴极得电子生成氨气,其电极方程式为:N2+6e-+6H+=2NH3;
(6)已知:①N2(g)+3H2(g)2NH3(g)△H=-92.4kJmol-1,
②2H2(g)+O2(g)2H2O(l)△H=-571.6kJmol-1,
由盖斯定律:①×2-②×3得2N2(g)+6H2O(l)4NH3(g)+3O2(g),
△H=(-92.4kJmol-1)×2-(-571.6kJmol-1)×3=+1530 kJmol-1。


科目:高中化学 来源: 题型:
【题目】物质的量相等的A、B两种气体,下列说法中错误的是( )
A. 分子数目一定相等
B. 体积一定相等
C. 质量不一定相等
D. 分子中的原子数目可能相等
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中的一定量混合气体发生反应:x A(g) + y B(g) ![]() z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
z C(g),平衡时测得A的浓度为0.5 mol/L,保持温度不变,将容器的容积扩大到原来的两倍,再次达到平衡时,测得A的浓度降低为0.3 mol/L,下列有关判断正确的是( )
A.x + y < z B.B的转化率降低
C.平衡向正反应方向移动 D.C的体积分数增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验现象,与新制氯水中的某些成分(括号内物质)没有关系的是( )
A.将NaHCO3固体加入新制氯水中,有无色气泡(H+)
B.使红色布条褪色(HCl)
C.向FeCl2溶液中滴加氯水,再滴加KSCN溶液,发现呈红色(Cl2)
D.滴加AgNO3溶液生成白色沉淀(Cl﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度下,将2molSO2和1molO2置于10L密闭容器中发生反应:2SO2(g)+O2(g) ![]() 2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
2SO3(g);ΔH<0,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是( )
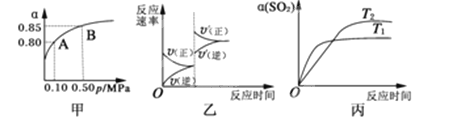
A. 由图甲推断,B点SO2的平衡浓度为0.3 mol·L-1
B. 由图甲推断,A点对应温度下该反应的平衡常数为800(L·mol-1)
C. 达平衡后,若增大容器容积,则反应速率变化图像可以用图乙表示
D. 压强为0.50 MPa时不同温度下SO2转化率与温度关系如丙图,则T2>T1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Na-S电池的结构如图所示,电池反应为2Na+![]() S8 =Na2Sn。下列说法不正确的是
S8 =Na2Sn。下列说法不正确的是

A. 熔钠电极作电池的负极 B. 放电时Na+向正极移动
C. 充电时熔钠电极与电源的正极相连 D. 充电时阳极反应式为8Sn2- —16e-=nS8
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com