
����Ŀ�����й��ڵ������Һ����������ȷ����( )
A��Na2CO3��NaHCO3��������Һ�У����������ͬ
B�������£�1 mol��L-1��CH3COOH��Һ��1 mol��L-1��NaOH��Һ�������Ϻ����û��Һ�У�c(Na+)>c(CH3COO-)>c(H+)>c(OH-)
C�����ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�c(NH![]() )ǰ��С�ں���
)ǰ��С�ں���
D�������£�ij��Һ����ˮ�������c(H+)��10-5 mol��L-1�������Һ����������
���𰸡�C
��������
���������A��NaHCO3��Һ��Na2CO3��Һ�����������ӡ������ӡ����������ӡ�̼������ӡ�̼��������ӣ���A����B�������£�1 mol��L-1��CH3COOH��Һ��1 mol��L-1��NaOH��Һ�������Ϻ�ǡ�����ɴ����ƣ�������ˮ�⣬��Һ�Լ��ԣ�c(Na+)>c(CH3COO-) >c(OH-) >c(H+)����B����C������������笠����ӵ�ˮ�⣬���ʵ���Ũ����ͬ��NH4Cl��NH4HSO4������Һ�У�c(NH![]() )ǰ��С�ں�������C��ȷ��D����ˮ�������c(H+)��10-5 mol��L-1��10-7 mol��L-1�������������ˮ�ĵ��룬��D����ѡC��
)ǰ��С�ں�������C��ȷ��D����ˮ�������c(H+)��10-5 mol��L-1��10-7 mol��L-1�������������ˮ�ĵ��룬��D����ѡC��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ʱ����ˮ����ˮ�����c(OH--)=a mol/L ��pH=1����������ˮ�����c(OH--)=b mol/L ��0.1mol/L�Ĵ�������Һ�У���ˮ�����c(OH--)=c mol/L ����a��b��c �Ĺ�ϵ��ȷ���� ( )
A��a>b=c B��c > a >b C��c>b>a D��b>c>a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ�ص�ԭ���������ij�ֳ������ϼ۵Ĺ�ϵͼ������ԭ��������������Ӧ��Ԫ�أ�������˵����ȷ����
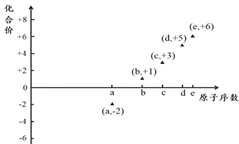
A. 31d��33d����ͬ�ֺ��� B. ��̬�⻯����ȶ��ԣ�a��d��e
C. ��ҵ�ϳ��õ�ⷨ�Ʊ�����b��c D. a��b�γɵĻ����ﲻ���ܺ����ۼ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ܱ�������A��B��Ӧ����C���䷴Ӧ���ʷֱ���v(A)��v(B)��v(C)��ʾ����֪v(A)��v(B)��v(C)֮�������¹�ϵ��2v(A)=3v(B), 3v(B)=2v(C)����˷�Ӧ�Ļ�ѧ����ʽ�ɱ�ʾΪ�� ��
A��2A+3B=2C B��A+3B=2C C��3A+2B=3C D��A+B=C
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ָ����Ӧ�����ӷ���ʽ��ȷ����
A. �ô����ȥˮ���е�̼��ƣ�CaCO3��2H����Ca2����H2O��CO2��
B. ����ˮ��Һ�ʼ��Ե�ԭ��S2-+2H2O![]() H2S��+2OH-
H2S��+2OH-
C. ��NaHCO3��Һ�м���������Ba(OH)2��Һ��Ba2++OH- +HCO3- =BaCO3��+ 2H2O
D. ��Na2FeO4��Һ�м���ϡ�������������4FeO42-+20H+=4Fe3++3O2��+10H2O
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ԭ��������С�������е����ֶ�����Ԫ��X��Y��Z��W������X��Z��W����Ԫ�ؿ����XH3��H2Z��HW���ۻ����Y����Ԫ�ؿ����Y2O��Y2O2���ӻ����
(1)д��Y2O2�ĵ���ʽ��__________�����к��еĻ�ѧ����_________��
(2)ZԪ�������ڱ��е�λ���ǵ�________���ڡ���________�塣X��Z�γɵ�һ�ֶ�Ԫ�������������ЧӦ������Է���������170��190֮�䣬��Z����������ԼΪ70%���û�����Ļ�ѧʽΪ____________________��
(3)X��Z��W����Ԫ�ص�����������Ӧ��ˮ�����У�ϡ��Һ��������ǿ����________(�ѧʽ)��
(4)XH3��H2Z��HW���ֻ��������һ�����������ֶ��ܷ�Ӧ����_________(�ѧʽ)��
(5)��X��W��ɵĻ���������У�X��Wԭ�ӵ��������ﵽ8�����ȶ��ṹ���û�������ˮ������һ�־���Ư���ԵĻ������д����Ӧ�Ļ�ѧ����ʽ________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����25 ����101 kPa�������£�����1 mol H��H������436 kJ����������1 mol Cl��Cl������243 kJ�������γ�1 mol H��Cl���ų�431 kJ������H2��Cl2===2HCl�Ļ�ѧ��Ӧ������ͼ��ʾ��

��ش������й����⣺
(1)��Ӧ��ϼ����յ�������Ϊ________��
(2)������ɼ��ų���������Ϊ________��
(3)�ж�H2��Cl2===2HCl��________(���������������ų���)������
(4)��Ӧ���������________(������������������������)���������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ںͽ�������ᣬ����Դ�Ͳ��ϵ�������Խ��Խ������ѧϰ��ѧ��Ϊ����ʶ���ʣ��������ʣ���������Դ����չ�������δ�������������й���Դ�����⣺
��1��δ������Դ���ص�����Դ�ḻ����ʹ��ʱ�Ի�������Ⱦ����Ⱦ��С���ҿ�����������������δ������Դ�����ǣ�________
����Ȼ����ú��������ʯ����̫��������������������������
A���٢ڢۢ� B���ݢޢߢ� C���ۢݢޢߢ� D���ۢܢݢޢߢ�
��2���˶�����ʹ�õĻ���ȼ��һ���DZ���(C3H8)����������������Ŀ��
����֪11g����(C3H8)��298K��101Kpa��������ȫȼ������CO2��Һ̬ˮʱ�ų�������Ϊ555kJ����д������ȼ���ȵ��Ȼ�ѧ����ʽ��_____________��
���Ա���(C3H8)�Ϳ���Ϊԭ�ϣ�ϡ����Ϊ�������Һ_____________(���ܻ���)��Ƴɳأ�
���ܣ���д��ͨ�����(C3H8)����һ��Ϊ��_____________����������_____________��������Ӧ��
�����ܣ��������ǣ�_____________��
��������һ�������·������ⷴӦ���Եõ���ϩ��
��֪��C3H8(g)��CH4(g)��HC��CH(g)��H2(g)��H1=+156.6kJ��mol��1
CH3CH=CH2(g)��CH4(g)��HC��CH(g)��H2=+32.4kJ��mol��1
����ͬ�����£���ӦC3H8(g)��CH3CH=CH2(g)��H2(g)����H=_______
��3����֪��H��H���ļ���Ϊ436KJ/mol��H��N���ļ���Ϊ391KJ/mol�����ݻ�ѧ����ʽ��N2+3H2![]() 2NH3��H=-92.4KJ/mol��
2NH3��H=-92.4KJ/mol��
��������N��N���ļ���Ϊ_______________��
�������������Ȼ�ѧ����ʽ��ͬ�¶Ⱥ����һ���������У�ͨ��1molN2��3molH2����ַ�Ӧ�ָ�ԭ�¶�ʱ�ų�������_______________92.4KJ(����ڻ�С�ڻ����)��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com