(2008?闵行区模拟)合成氨工业对国民经济和社会发展具有重要的意义,合成氨气所需的氢气可以由水煤气分离得到.涉及反应信息如下:
反应①:C(s)+H
2O(g)
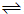
H
2(g)+CO(g) 平衡常数K
1反应②:平衡常数 K
2=
(1)K
1的表达式:K
1=
;反应②的化学方程式为
CO+H
2O
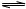
H
2+CO
2CO+H
2O
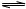
H
2+CO
2.
(2)在恒容时,对反应①,不能判断该反应达到化学平衡状态的是
D
D
(填序号).
A.容器中压强不变 B.混合气体中CO浓度不变
C.υ(H
2)
正=υ(H
2O)
逆 D.c(H
2O)=c(CO)
(3)将一定量的H
2O(g)和CO(g)分别通入到体积为1L的密闭容器中,在不同条件下进行反应,得到以下三组数据:
| 实验组别 |
温度/℃ |
起始量/mol |
平衡量/mol |
达到平衡所需时间/min |
| H2O |
CO |
H2 |
CO |
| 1 |
650 |
1 |
2 |
0.8 |
1.2 |
5 |
| 2 |
900 |
0.5 |
1 |
0.2 |
0.8 |
3 |
| 3 |
T |
a |
b |
c |
d |
t |
(Ⅰ)实验1中,用CO
2表示反应开始到平衡的平均反应速率为
0.16mol/(L?min)
0.16mol/(L?min)
;
(Ⅱ)在实验3,当a=0.5、b=1时,要使c、d数据与实验2相同,且t<3,可以采取的措施为
D
D
(填序号)
A.其它条件不变温度T<900℃B.其它条件不变温度T>900℃
C.充入一定量氖气 D.使用高效催化剂
(Ⅲ)对于反应②,当升高温度时K
2减小
减小
(填“增大”、“减小”或“不变”).

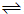 H2(g)+CO(g) 平衡常数K1
H2(g)+CO(g) 平衡常数K1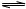 H2+CO2
H2+CO2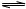 H2+CO2
H2+CO2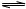 H2+CO2,故答案为:
H2+CO2,故答案为: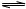 H2+CO2;
H2+CO2;

 海淀黄冈名师导航系列答案
海淀黄冈名师导航系列答案 普通高中同步练习册系列答案
普通高中同步练习册系列答案 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案



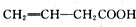
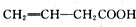


 ;
;
