
 zC(气),达到平衡时测得A气体的浓度为0.5 mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol/L,则下列叙述正确的是
zC(气),达到平衡时测得A气体的浓度为0.5 mol/L,当在恒温下将该容器体积扩大一倍,再次达到平衡,测得A气体的浓度为0.3 mol/L,则下列叙述正确的是| A.x+y<z | B.平衡向右移动 |
| C.B的转化率升高 | D.C的体积分数降低 |
科目:高中化学 来源:不详 题型:单选题
 2NH3,下列有关推断正确的是
2NH3,下列有关推断正确的是| A.3mol H2与足量的N2在该容器内充分反应可生成2mol NH3 |
| B.当生成N2和NH3的速率之比为1:2时反应处于平衡状态 |
| C.在相同的温度和压强下,与不使用催化剂相比,使用催化剂可以提高平衡混合物中NH3的含量 |
| D.当反应速率之比v(N2): v(H2): v(NH3)=1:3:2时,反应处于平衡状态 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
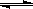 2R(g);△H>0 ,y 轴表示的是
2R(g);△H>0 ,y 轴表示的是
| A.平衡时,混合气中R的百分含量 |
| B.平衡时,混合气中G的百分含量 |
| C.G的转化率 |
| D.L的转化率 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
 N2(g) +3 H2(g) ;在某温度下,在2 L密闭容器中加入一定量的NH3,反应到10分钟时各组分的浓度不再改变,此时测得各组分的浓度如下:
N2(g) +3 H2(g) ;在某温度下,在2 L密闭容器中加入一定量的NH3,反应到10分钟时各组分的浓度不再改变,此时测得各组分的浓度如下:| 物质 | NH3 | N2 | H2 |
| 物质的量(mol) | 0. 1 | 0.2 | 0.6 |
 条件可使现有平衡移动
条件可使现有平衡移动查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
 2SO3(g) ΔH<0。某温度下,将2 mol SO2和
2SO3(g) ΔH<0。某温度下,将2 mol SO2和 1 mol O2置于10 L密闭容器中,反应达平衡后
1 mol O2置于10 L密闭容器中,反应达平衡后 ,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是
,SO2的平衡转化率(α)与体系总压强(p)的关系如图甲所示。则下列说法正确的是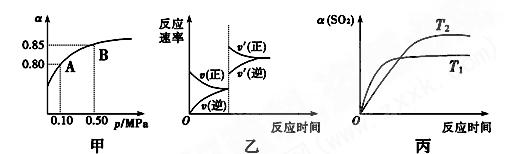
| A.由图甲知,A点SO2的平衡浓度为0.4 mol·L-1 |
| B.由图甲知,B点SO2、O2、SO3的平衡浓度之比为2∶1∶2 |
| C.达平衡后,缩小容器容积,则反应速率变化图象可以用图乙表示 |
D.压强为0.50 MPa时不同温度下 SO2转化率与温度关系如丙图,则T2>T1 SO2转化率与温度关系如丙图,则T2>T1 |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
| t℃ | 700 | 800 | 830 | 1000 | 1200 |
| K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
 。
。 )·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________
)·c(H2)=c(CO)·c(H2O)。试判断此时的温度为_____________查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
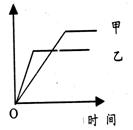
| | 反应 | 纵坐标 | 甲 | 乙 |
| A | 等质量钾、钠分别与水反应 | H 2质量 | 钠 | 钾 |
| B | 相同质量氨,在同一容器中 2NH3 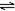 N2+3H2 N2+3H2 | 氨气的转化率 | 500℃ | 400℃ |
| C | 体积比1:3的N2,H2,在体积可变的恒压容器中,2NH3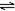 N2+3H2 N2+3H2 | 氨气的浓度 | 活性高的催化剂 | 活性一般的催化剂 |
| D | 2 mol S02与l mol 02,在相同温度下2S02+02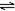 2S03 2S03 | S03物质的量 | 10atm | 2atm |
查看答案和解析>>
科目:高中化学 来源:不详 题型:填空题
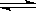 CO(g)+H2(g)△H=131.5kJ·mol-1
CO(g)+H2(g)△H=131.5kJ·mol-1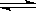 2CO(g)△H=172.5kJ·mol-1
2CO(g)△H=172.5kJ·mol-1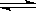 CO2(g)+H2(g)的焓变(△H)为 。
CO2(g)+H2(g)的焓变(△H)为 。 CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。
CH3OH(g)。甲醇是一种燃料,可用于设计燃料电池。下图是甲醇燃料电池的原理示意图。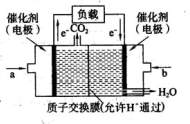 ①a处通入的是 (填物质名称),左侧电极上发
①a处通入的是 (填物质名称),左侧电极上发 CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据:
CO2(g)+H2(g)△H=akJ·mol-1,得到下列数据: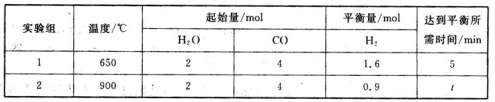
查看答案和解析>>
科目:高中化学 来源:不详 题型:单选题
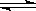 C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是
C(g)+2D(g)达到平衡后,升高温度容器内气体的密度增大,则下列叙述一定正确的是| A.正反应是吸热反应,且A不是气态 |
| B.正反应是放热反应,且A是气态 |
| C.加入少量C,物质A的转化率增大 |
| D.改变压强对该平衡的移动无影响 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com